Kvanteprikker sporer, hvem der kommer ind i cellekernen
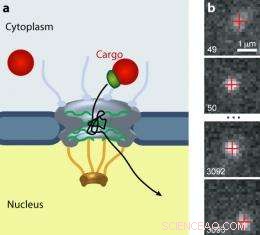
Det nukleare porekompleks (NPC) lukker trafikken af alle molekyler mellem cytoplasmaet og kernen af eukaryote celler. (a) Større laster (rød) kræver en transportreceptor (grøn) for at passere gennem porten. (b) En quantum dot last bevæger sig gennem en NPC. Billede:Alan Lowe
(PhysOrg.com) -- UC Berkeley-forskere Karsten Weis, Jan Liphardt, og kolleger har brugt fluorescerende prober kaldet kvanteprikker til at bestemme, hvilke molekyler der kommer ind i kernen via dens nanoporer, og hvilke der bliver sparket ud igen. Deres resultater kan hjælpe med at designe lægemidler, der kan trænge gennem porerne og målrette mod en celles DNA.
QB3-biofysikere har sporet med hidtil uset opløsning sporene for laster, der bevæger sig gennem det nukleare porekompleks (NPC), en selektiv nanoskalaåbning, der styrer adgangen til cellens kerne, og besvarede flere centrale spørgsmål om dens funktion.
NPC, en stor proteinsamling formet som et basketballnet omkranset med tentakler, er porten til cellekernen, hvor genetisk information opbevares. Hver cellekerne indeholder ca. 2, 000 NPC'er, indlejret i atomhylsteret. NPC'en (som er omkring 50 nanometer bred) er ansvarlig for al transport ind og ud af kernen. For at forhindre indholdet af resten af cellens indre i at blande sig med kernens indhold, NPC skelner mellem laster med stor præcision.
Adskillige vira målretter NPC for at få adgang til kernen, og dysfunktionel transport mellem cytoplasmaet og kernen har været impliceret i flere sygdomme, herunder cancer.
Forskere har konstrueret modeller til NPC, men hvordan denne kanal fungerer og opnår sin selektivitet er forblevet et mysterium. Det er kendt, for at komme igennem NPC, store molekyler skal binde mindst nogle få receptorer kaldet "importiner"; om binding af flere importer fremskynder eller bremser et molekyles passage har været uklart. Så, også, har det nøjagtige punkt, hvor et bærerprotein kaldet "Ran" spiller en afgørende rolle, erstatte et molekyle af GTP (et cellulært brændstof, en analog af den bedre kendte ATP) for en af BNP, som det store molekyle bringer med sig, når det kommer ind i NPC.
Karsten Weis, en UC Berkeley professor i molekylær- og cellebiologi, Jan Liphardt, en UC Berkeley professor i fysik, og kolleger udførte avancerede billeddiagnostiske eksperimenter, der løste disse problemer. (Weis og Liphardt er medlemmer af QB3.) Forskningen blev offentliggjort den 1. september i tidsskriftet Natur , i et papir, hvor Berkeley post-doc Alan Lowe og kandidatstuderende Jake Siegel var fælles førsteforfattere.
Tidligere, videnskabsmænd havde observeret bevægelsen af små molekyler (et par nm i diameter), mærket med fluorescerende tags, gennem NPC. Men den hurtige transit og svage signal fra disse molekyler resulterede i sparsomme, slørede data. Lowe, Siegel, et al. ansat "kvanteprikker", som er omkring 20 nm i diameter - og dermed langsommere end mindre molekyler - og meget lysere end konventionelle fluoroforer. Forskerne har belagt kvanteprikkerne med signaler genkendt af importins. Ved at bruge en mikroskopisk teknik, der gjorde det muligt for dem at se en flad, tynd visuel skive gennem levende celler, de så hundredvis af individuelle prikker komme ind, vipper rundt i, blive smidt ud fra, og i nogle tilfælde indrømmet gennem, NPC'er. Forskerne optog videodata og sporede bevægelsen af 849 kvanteprikker med nanometerpræcision.
Kvanteprikkernes spaghetti-lignende stier, overlejret på hinanden, afslørede, at partiklerne faldt i tre klasser:"tidlige aborter, ” som kortvarigt blev indespærret og derefter hoppede ud; "sen aborter, ” som vandrede ind og bugtede sig til den indre ende af poren, før de forlod den vej, de kom; og "succeser, ” som fulgte stort set samme veje som de sene aborter, men fik adgang.
Fra stiernes uberegnelige bugtninger, forskerne udledte, at kvanteprikkerne faktisk spredte sig tilfældigt, frem for at blive aktivt transporteret. Og at tilføje flere importins til prikkernes belægning forkortede transittiden, tyder på, at importins gør indgående last mere opløselig inden for NPC i stedet for at binde sig til indvendige vægge.
Forskerne fandt et særligt interessant resultat, da de tilbageholdt bærerproteinet Ran fra eksperimentet. Uden Ran i blandingen, kvanteprikkerne fulgte nøjagtig den samme række af stier, som da Ran var til stede, bortset fra at stort set ingen passerede gennem NPC.
I betragtning af deres stidata, forfatterne tegnede en model for, hvordan NPC fungerer. Stor last er i første omgang fanget af NPC's filamentkant. Så støder den på en forsnævring, hvorigennem den kan komme ind i et slags forkammer. Derefter, i visse tilfælde, Ran udveksler lastens BNP med en GTP, og den optages i kernen. Kun det sidste trin er irreversibelt.
"Det er et elegant studie, " siger Michael Rout, en professor i cellulær og strukturel biologi ved The Rockefeller University, hvis speciale er NPC-transport. "Hvis vi til sidst forstår, hvordan NPC fungerer på det mest subtile niveau, vi kunne måske bygge filtre til at vælge molekyler af interesse."
Ja, en af de vigtigste nye indsigter er, at NPC's selektivitet synes at være resultatet af en kaskade af filtre, hver foretrækker korrekte laster, snarere end blot et meget selektivt skridt. Dette er med til at forklare, hvorfor nogle ting nemt kan komme ind i kernen, og andre ting er udelukket. Denne opdagelse kan have nogle meget praktiske kliniske implikationer, Liphardt og Weis siger. Det kan gøre det muligt for forskere at udvikle teknikker til effektivt at levere store menneskeskabte laster, såsom lægemiddel-polymer-konjugater og kontrastmidler, til kernen, som indeholder genomet.
 Varme artikler
Varme artikler
-
 En lille friktion går langt mod stærkere nanorørfibreRice University-forskere modellerede forholdet mellem længden af kulstofnanorør og de friktionsforårsagende tværbindinger mellem dem i en fiber og fandt ud af, at forholdet kan bruges til at måle fi
En lille friktion går langt mod stærkere nanorørfibreRice University-forskere modellerede forholdet mellem længden af kulstofnanorør og de friktionsforårsagende tværbindinger mellem dem i en fiber og fandt ud af, at forholdet kan bruges til at måle fi -
 Blyantstegning af en sensor er faktisk en sensorEn blyant-på-papir PZR-sensor med et integreret kredsløb til måling af sensorens spændingsændring under påført stress. Kredit:Kang ©2014 AIP Publishing Brug grafitblyanter til at tegne på almindel
Blyantstegning af en sensor er faktisk en sensorEn blyant-på-papir PZR-sensor med et integreret kredsløb til måling af sensorens spændingsændring under påført stress. Kredit:Kang ©2014 AIP Publishing Brug grafitblyanter til at tegne på almindel -
 At finde blandingen:Solcelleeffektivitet en delikat balanceEt nanoskala interiør af en solcelle (Phys.org) - Forskning fra North Carolina State University afslører, at solcelleeffektivitet er baseret på en delikat balance mellem størrelsen og renheden af
At finde blandingen:Solcelleeffektivitet en delikat balanceEt nanoskala interiør af en solcelle (Phys.org) - Forskning fra North Carolina State University afslører, at solcelleeffektivitet er baseret på en delikat balance mellem størrelsen og renheden af -
 Højfølsom kemisk billeddannelse på nanoskala med hård røntgen-nano-XANESOpkøb af nano-XANES. (A) Skematisk af den hårde røntgen-nanoprobe-strålelinje af NSLS-II. Da prøven rasterscannes af en nanostråle produceret fra en Fresnel-zoneplade (FZP), diffraktion (ikke brugt ti
Højfølsom kemisk billeddannelse på nanoskala med hård røntgen-nano-XANESOpkøb af nano-XANES. (A) Skematisk af den hårde røntgen-nanoprobe-strålelinje af NSLS-II. Da prøven rasterscannes af en nanostråle produceret fra en Fresnel-zoneplade (FZP), diffraktion (ikke brugt ti
- Istidens fodspor af mammutter og forhistoriske mennesker afsløret for første gang ved hjælp af ra…
- Nye fejlmeddelelser tidligere slutter til Google+ sociale netværk
- Sådan beregner du batteriudladningshastighed
- Undersøgelse hjælper med at bevise galakseevolutionsteori
- Kinas månedlige bilsalg stiger i april; Salget af elbiler fordobles
- 600 seismografer lytter ind i Alperne


