Nyt nano-stof rammer hjernetumormål fundet i 2001
For ni år siden, forskere ved Cedars-Sinais Maxine Dunitz Neurokirurgiske Institut opdagede et subtilt skift i den molekylære sammensætning af den mest aggressive type hjernetumorer, glioblastoma multiforme. Med yderligere undersøgelse, de fandt ud af, at et specifikt protein kaldet laminin-411 spiller en vigtig rolle i en tumors evne til at bygge nye blodkar for at understøtte dets vækst og spredning. Men teknologien eksisterede ikke dengang for at blokere dette protein.
Nu, anvender ny lægemiddelteknologi, der er en del af en avanceret videnskab kaldet nanomedicin, forskergruppen har skabt et "nanobiokonjugat" -lægemiddel, der kan gives ved intravenøs injektion og transporteres i blodet for at målrette hjernetumoren. Det er konstrueret til specifikt at gennemsyre tumorcellevæggen, ind i endosomer, mobile rum i cellerne.
Når endosomer modnes, de vokser sure (lav pH), og en kemisk komponent i lægemidlet udløser på dette tidspunkt, bryde endosomernes membraner. Frigjorte lægemidler blokerer tumorcellens produktion af laminin-411, det "ondartede" protein i nye tumorkar. Efter sin natur, lægemidlet er ugiftigt for ikke-tumorceller; bivirkninger forbundet med konventionel kemoterapi er ikke et problem med denne klasse af lægemidler.
Denne tilgang menes at være den første af sin art-den første anvendelse af en pH-afhængig endosom-flugt-enhed i lægemidler administreret intravenøst til behandling af kræft i hjernen-som rapporteret i Procedurer fra National Academy of Sciences . Undersøgelser i laboratoriemus viser, at dette system tillader store mængder antitumormedicin at akkumulere i tumorer, markant bremse væksten af nye fartøjer og selve tumorerne. Tumorer hos dyr behandlet med lægemidlet var 90 procent mindre end dem i en kontrolgruppe.
Gliomas, en type ondartede hjernetumorer, er ekstremt vanskelige at behandle. Deres tendens til at sprede sig til sundt hjernevæv og deres evne til at dukke op igen fjerntliggende steder gør dem praktisk talt umulige at fjerne helt kirurgisk. De modstår kemoterapi og strålebehandling, og selve hjernen er "beskyttet" af blod-hjerne-barrieren og immunsystemmekanismer, der modarbejder de fleste terapier.
Systemet udviklet på Cedars-Sinai-et nanobiokonjugat-ser ud til at klare store forhindringer for behandling af hjernetumorlægemidler. Nanokonjugater er den seneste udvikling af molekylære lægemidler designet til at komme ind i celler og specifikt ændre definerede mål i dem. Som foreslået af udtrykket "biokonjugat, "disse systemer indeholder kemiske" moduler "fastgjort (konjugeret) til en leveringsvogn med stærke kemiske bindinger. Sådanne bindinger forhindrer komponenterne i at blive beskadiget eller adskilt i væv eller blodplasma under transit. Men med opfindsom lægemiddelteknik, antitumorkomponenten aktiveres direkte inde i tumorceller.
Et nanokonjugat eksisterer som en enkelt kemisk enhed, med sine komponenter, der udfører kritiske opgaver i en forudbestemt sekvens og angriber flere mål samtidigt. Det ultimative angreb på en tumorcelle afhænger af et kompleks, velkoreograferet kæde af biokemiske begivenheder, såsom:penetrering af blod-hjerne-barrieren og blod-hjerne-tumorbarrieren; specifikt homing til tumorceller; gennemtrængende væggene i blodkar og tumorceller; frigivelse af antitumormedicin på det rigtige sted og tidspunkt; og demonteringsmekanismer, der hjælper tumor-fodrende blodkar med at vokse.
"Dette nanobioconjugat er forskelligt fra tidligere nanomedicin -lægemidler, fordi det leverer og frigiver antitumorlægemidler i tumorceller, ikke kun på stedet for en tumor, "sagde forsker Julia Y. Ljubimova, M.D., Ph.d., seniorforfatter af artiklen. Hun leder Drug Delivery and Nanomedicine Laboratory i afdelingen for neurokirurgi på Cedars-Sinai. Andre store bidragydere til denne undersøgelse og artiklen omfatter:Hui Ding, Ph.d., og Eggehard Holler, Ph.d., kemikere, biokemikere og immunologer. Holler er tilknyttet både Cedars-Sinai og University of Regensburg i Tyskland.
Cedars-Sinais stof, et makromolekyle på 20 til 30 nanometer i størrelse, er baseret på en stærkt oprenset form for polymalsyre afledt af enkeltcelleorganismen Physarum polycephalum. Når nanokonjugatet har udført sine opgaver, kroppen fordøjer det fuldstændigt, efterlader ingen skadelige rester.
"Baseret på vores undersøgelser, dette nanokonjugat ser ud til at være en sikker og effektiv leveringsplatform, der også kan være hensigtsmæssig i behandlingen af degenerative hjernesygdomme og en lang række andre lidelser. Det nedbrydes harmløst til kuldioxid og vand, ikke -toksisk for normalt væv, og, i modsætning til nogle lægemidler, det er ikke-immunogent, hvilket betyder, at det ikke stimulerer immunsystemet til at forårsage allergiske reaktioner, der kan variere fra mild hoste eller udslæt til pludselige, livstruende symptomer, "Sagde Ljubimova. Forskere forventer, at menneskelige kliniske forsøg med lægemidlet vil begynde i den nærmeste fremtid.
Sidste artikelTest viser lys fremtid for gadonanorør i stamcellesporing
Næste artikelForskere skaber verdens første supersnoede lys
 Varme artikler
Varme artikler
-
 Nanomaterialer klar til stor indflydelse i byggerietRice Universitys Pedro Alvarez (til venstre) og Jaesang Lee gennemgik mere end 140 videnskabelige artikler for at undersøge byggeindustriens potentielle anvendelser af nanomaterialer. Kredit:Jeff Fitl
Nanomaterialer klar til stor indflydelse i byggerietRice Universitys Pedro Alvarez (til venstre) og Jaesang Lee gennemgik mere end 140 videnskabelige artikler for at undersøge byggeindustriens potentielle anvendelser af nanomaterialer. Kredit:Jeff Fitl -
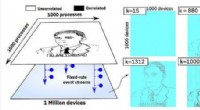 IBM-forskere demonstrerer in-memory computing med 1 million enheder til applikationer i AIEn million processer er kortlagt til pixels i en 1000 × 1000 pixel sort-hvid skitse af Alan Turing. Pixels tændes og slukkes i overensstemmelse med de øjeblikkelige binære værdier af processerne. Kred
IBM-forskere demonstrerer in-memory computing med 1 million enheder til applikationer i AIEn million processer er kortlagt til pixels i en 1000 × 1000 pixel sort-hvid skitse af Alan Turing. Pixels tændes og slukkes i overensstemmelse med de øjeblikkelige binære værdier af processerne. Kred -
 Fleksibel enhed fanger energi fra menneskelig bevægelseKredit:Michigan State University Dagen med opladning af mobiltelefoner med fingerstryg og strømforsyning til Bluetooth-headset ved blot at gå er nu meget tættere på. Michigan State University ing
Fleksibel enhed fanger energi fra menneskelig bevægelseKredit:Michigan State University Dagen med opladning af mobiltelefoner med fingerstryg og strømforsyning til Bluetooth-headset ved blot at gå er nu meget tættere på. Michigan State University ing -
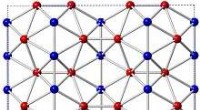 Bor får en nano-opdatering:Forskere finder stabile 2D-strukturer med unikke egenskaberProjektioner af 2 × 2 × 1 supercelle af Pmmn-bor-struktur langs [001] og [100] retninger. (Phys.org) – National Nanotechnology Initiative definerer nanoteknologi som forståelse og kontrol af stof
Bor får en nano-opdatering:Forskere finder stabile 2D-strukturer med unikke egenskaberProjektioner af 2 × 2 × 1 supercelle af Pmmn-bor-struktur langs [001] og [100] retninger. (Phys.org) – National Nanotechnology Initiative definerer nanoteknologi som forståelse og kontrol af stof
- Cyberkriminelle:Tingene er ved at blive meget mere forvirrende for dig
- Team udvikler genkredsløbsdesignstrategi for at fremme syntetisk biologi
- Billede:Rose-farvet Jupiter
- Canada, hvis Trudeau vinder, at ramme nul -emissioner inden 2050:minister
- Hvordan har NASA forbedret solenergi?
- Nyt Zooniverse-projekt - myonjæger


