Forskere kombinerer tumor-målrettede peptider og nanopartikler for at ødelægge glioblastom
Glioblastoma er en af de mest aggressive former for kræft i hjernen. I stedet for at præsentere som en veldefineret tumor, glioblastom vil ofte infiltrere det omgivende hjernevæv, gør det ekstremt svært at behandle kirurgisk eller med kemoterapi eller stråling. Ligeledes, flere musemodeller af glioblastom har vist sig at være fuldstændig resistente over for alle behandlingsforsøg.
I en ny undersøgelse, et team ledet af forskere ved Sanford-Burnham Medical Research Institute (Sanford-Burnham) og Salk Institute for Biological Studies udviklede en metode til at kombinere et tumor-homing peptid, et celledræbende peptid, og en nanopartikel, der både forbedrer tumorcelledød og giver forskerne mulighed for at forestille sig tumorer. Når det bruges til behandling af mus med glioblastom, dette nye nanosystem udryddede de fleste tumorer i en model og betydeligt forsinkede tumorudvikling i en anden. Disse resultater blev offentliggjort ugen den 3. oktober i Procedurer fra National Academy of Sciences .
"Dette er et unikt nanosystem af to grunde. For det første at forbinde celledrabende peptid med nanopartikler gjorde det muligt for os at levere det specifikt til tumorer, næsten eliminerer morderpeptidets toksicitet for normale væv. Sekund, normalt er forskere og klinikere glade, hvis de er i stand til at levere flere lægemidler til en tumor end til normale væv. Det har vi ikke kun opnået, men var i stand til at designe vores nanopartikler til at levere morderpeptidet lige der, hvor det virker - mitokondrierne, cellens energigenererende center, "sagde Erkki Ruoslahti, M.D., Ph.d., seniorforfatter af undersøgelsen og fornem professor i både Sanford-Burnhams NCI-udpegede Cancer Center i La Jolla og Center for Nanomedicine, et Sanford-Burnham-samarbejde med University of California, Santa Barbara.
Nanosystemet udviklet i denne undersøgelse består af tre elementer. Først, en nanopartikel fungerer som bærerammen for et billeddannelsesmiddel og for to peptider (korte proteiner). Et af disse peptider styrer nanopartiklen og dens nyttelast specifikt til kræftceller og de blodkar, der fodrer dem, ved at binde celleoverflademarkører, der adskiller dem fra normale celler. Det samme peptid driver også hele systemet inde i disse målceller, hvor det andet peptid ødelægger mitokondrierne, udløser cellulært selvmord gennem en proces kendt som apoptose.
Sammen, disse peptider og nanopartikler viste sig at være yderst effektive til behandling af to forskellige musemodeller af glioblastom. I den første model, behandlede mus overlevede betydeligt længere end ubehandlede mus. I den anden model, ubehandlede mus overlevede i kun otte til ni uger. I skarp kontrast, behandling med dette nanosystem helbredte alle på nær én af ti mus. Hvad mere er, ud over at tilbyde terapi, nanopartiklerne kan hjælpe med at diagnosticere glioblastom; de er lavet af jernoxid, hvilket gør dem - og derfor de tumorer, de retter sig mod - synlige ved MR, den samme teknik, der allerede er brugt til at diagnosticere mange helbredstilstande.
I et sidste twist, forskerne gjorde hele nanosystemet endnu mere effektivt ved at administrere det til musene i forbindelse med et tredje peptid. Dr. Ruoslahti og hans team viste tidligere, at dette peptid, kendt som iRGD, hjælper samtidig administrerede lægemidler med at trænge dybt ind i tumorvæv. iRGD har vist sig at øge behandlingseffektiviteten af forskellige lægemidler mod humant bryst betydeligt, prostata, og kræft i bugspytkirtlen hos mus, at opnå den samme terapeutiske effekt som en normal dosis med en tredjedel så meget af lægemidlet. Her, iRGD forbedret nanopartikelpenetration og terapeutisk effekt.
"I dette studie, vores patienter var mus, der udviklede glioblastomer med de samme egenskaber som observeret hos mennesker med sygdommen. Vi behandlede dem systemisk med nanopartiklerne. Når nanopartiklerne nåede tumorenes blodkar, de leverede deres nyttelast (et lægemiddel) direkte til cellens elproducent, mitokondrierne. Ved at ødelægge blodkarrene og også nogle omkringliggende tumorceller, vi var i stand til at helbrede nogle mus og forlænge resten af levetiden, "sagde Dinorah Friedmann-Morvinski, Ph.d., medforfatter af undersøgelsen og postdoktoral forskningsassistent i laboratoriet i Inder Verma, Ph.d. på Salk Institute.
 Varme artikler
Varme artikler
-
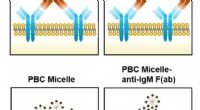 Forskere forklarer, hvordan nanomateriale hjælper antistofresponsIllustrationen viser, hvordan et nanomateriale forbinder sig med receptorer på immunsystemets B-celler og hjælper dem med at igangsætte antistofproduktion. De to øverste paneler viser anti-immunoglobu
Forskere forklarer, hvordan nanomateriale hjælper antistofresponsIllustrationen viser, hvordan et nanomateriale forbinder sig med receptorer på immunsystemets B-celler og hjælper dem med at igangsætte antistofproduktion. De to øverste paneler viser anti-immunoglobu -
 To-trins strømstyringssystem øger effektiviteten til energihøstTriboelektriske nanogeneratorer bruger en kombination af den triboelektriske effekt og elektrostatisk induktion til at generere små mængder elektrisk strøm fra mekaniske bevægelser såsom rotation, gli
To-trins strømstyringssystem øger effektiviteten til energihøstTriboelektriske nanogeneratorer bruger en kombination af den triboelektriske effekt og elektrostatisk induktion til at generere små mængder elektrisk strøm fra mekaniske bevægelser såsom rotation, gli -
 Grafen kan være nøglen til at kontrollere vandfordampningenDenne visualisering viser lag af grafen, der bruges til membraner. Kredit:University of Manchester Grafenbelægninger kan give mulighed for at kontrollere vandfordampningsprocessen fra forskellige
Grafen kan være nøglen til at kontrollere vandfordampningenDenne visualisering viser lag af grafen, der bruges til membraner. Kredit:University of Manchester Grafenbelægninger kan give mulighed for at kontrollere vandfordampningsprocessen fra forskellige -
 Forskeren opfinder en let at bruge teknik til at måle hydrofobiciteten af mikro- og nanopartiklerLet at bruge optisk metode til kvantitativt at bestemme overfladefri energi af mikro- og nanopartikler. Kredit:American Chemical Society De videnskabelige og industrisamfund, der arbejder med mikr
Forskeren opfinder en let at bruge teknik til at måle hydrofobiciteten af mikro- og nanopartiklerLet at bruge optisk metode til kvantitativt at bestemme overfladefri energi af mikro- og nanopartikler. Kredit:American Chemical Society De videnskabelige og industrisamfund, der arbejder med mikr


