Magnetisk nanokæde detonerer kemo spærre inde i tumorer
Medicin-toting nanokæder glider ind i tumorer og eksploderer et kemoterapi-lægemiddel i svært tilgængelige kerner af kræft, ingeniører og videnskabsmænd ved Case Western Reserve University rapport.
I forsøg på rotter og mus, teknologien tog langt flere kræftceller ud, hæmmede tumorvækst bedre og forlængede levetiden længere end traditionel kemoterapi.
Alt imens, det målrettede leveringssystem brugte langt mindre af lægemidlet doxorubicin end den mængde, der blev brugt i traditionel kemoterapi, at redde sundt væv fra giftig eksponering.
Det nye leveringssystem og resultater er beskrevet i onlineudgaven af tidsskriftet The American Chemical Society ACS Nano .
"Anden nanoteknologi er blevet brugt til at få et lægemiddel ind i en tumor, men når stoffet først kommer ind af døren, den bliver ved døren, mangler det meste af bygningen, " sagde Efstathios Karathanasis, en biomedicinsk ingeniørprofessor og leder af forskerholdet. "Vi brugte en anden form for nanoteknologi til at smugle stoffet ind i tumoren og til at eksplodere bomben, frigiver stoffet i sin frie form for at spredes gennem hele tumoren."
Nøglen til det nye leveringssystem er halen på doxorubicinbomben.
Karathanasis' hold tog magnetiske nanopartikler lavet af jernoxid og modificerede overfladerne, så den ene ville linke til den næste, meget ligesom Lego byggeklodser.
De kædede tre sammen og forbandt kemisk en liposomkugle fyldt med lægemidlet.
De injicerede derefter rotte- og musemodeller med nanokæderne, som kun indeholdt 5 til 10 procent af doxorubicin, der blev brugt i standard kemoterapi. De to gnavere er modeller af to forskellige stammer af det, der kaldes triple-negativ brystkræft, en meget aggressiv form for kræft, der kun kan behandles med hård kemoterapi.
Forskerne startede med en aggressiv form, tror på, om teknologien virker på de mindst behandlingsbare kræftformer, det er sandsynligt, at det virker sammen med andre lægemidler på andre former for kræft.
En dag senere, efter at nanokæder var gledet fra blodbanen og samlet sig i tumoren, forskerne placerede en trådspole, kaldet en solenoide, uden for dyremodellerne, nær tumoren. Elektricitet, der føres gennem solenoiden, skaber et radiofrekvensfelt. Feltet fik de magnetiske haler til at vibrere, bryder liposomkuglerne op.
To uger efter behandlingen, tumorvækst hos rotter, der modtog det nye lægemiddel, var mindre end halvdelen af væksten hos rotter, der blev behandlet traditionelt. Hos rotter, der fik to af de nye behandlinger, tumorvækst blev reduceret til en tiendedel af rotter behandlet traditionelt (f.eks. klinisk anvendt doxorubicin eller liposomalt doxorubicin).
Rotter, der modtog én ny behandling, overlevede i gennemsnit 25 dage, og de, der blev behandlet to gange, 46 dage, sammenlignet med 15 dage for traditionelt behandlede rotter.
Celledød, kaldet apoptose, inden for tumoren var mindst 10 gange større efter én behandling med det nye leveringssystem sammenlignet med traditionel behandling.
Forskerne testede kun for apoptose hos mus med en anden triple-negativ cellelinje. Den nye behandling forårsagede næsten en 4-faldig stigning i celledød i tumoren.
Hos både mus og rotter, stoffet og den resulterende celledød var langt mere udbredt i tumorerne med nanochain-leveringen.
"Der er sandsynligvis forskellige vækstmekanismer i de forskellige modeller, hvilket indikerer, at denne teknologi sandsynligvis vil fungere i forskellige typer kræft, " sagde Ruth Keri, lektor og næstformand for Institut for Farmakologi ved Case Western Reserve School of Medicine. Keri, som også er associeret direktør for grundforskning ved Case Comprehensive Cancer Center, bistået i efterforskningen.
"Dette er en virkelig smart og ny tilgang til målrettet levering. Men, vi har brug for meget mere test."
Under deres eksperimenter, holdet fandt ud af, at de kunne kontrollere hastigheden af frigivelse af lægemidler ved at justere radiofrekvensen, der bruges til at vibrere kæden.
De planlægger at udforske denne evne yderligere og teste, om systemet kan blokere tumorens evne til at metastasere, som er den hyppigste årsag til kræftdødsfald. De vil også optimere systemet for at give mere effektiv og hurtig lægemiddelfrigivelse, og yderligere evaluere effekten af størrelse og form af nanokæderne på blodcirkulationen og tumorpenetration.
 Varme artikler
Varme artikler
-
 Kolloide kvanteprikker får LED'er til at lyse klart i det infrarødeDr. Santanu Pradhan, første forfatter, forklarer eksperimentresultaterne til ICREA Prof. hos ICFO Gerasimos Konstantatos, gruppeleder af forskningsgruppen på ICFO. Kredit:ICFO Det ideelle optoelek
Kolloide kvanteprikker får LED'er til at lyse klart i det infrarødeDr. Santanu Pradhan, første forfatter, forklarer eksperimentresultaterne til ICREA Prof. hos ICFO Gerasimos Konstantatos, gruppeleder af forskningsgruppen på ICFO. Kredit:ICFO Det ideelle optoelek -
 Små nanopartikler giver et stort potentiale for behandling af hjernekræftKredit:Yale University For patienter med ondartede hjernetumorer, prognosen forbliver dyster. Med de mest aggressive behandlinger til rådighed, patienter forventes normalt først at leve omkring 14
Små nanopartikler giver et stort potentiale for behandling af hjernekræftKredit:Yale University For patienter med ondartede hjernetumorer, prognosen forbliver dyster. Med de mest aggressive behandlinger til rådighed, patienter forventes normalt først at leve omkring 14 -
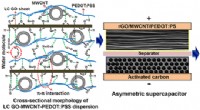 Wafertyndt materiale varsler fremtiden for bærbar teknologiUOWs Institute for Superconducting and Electronic Materials (ISEM) har med succes været banebrydende for en måde at konstruere en fleksibel, sammenfoldelig og let energilagringsenhed, der udgør bygges
Wafertyndt materiale varsler fremtiden for bærbar teknologiUOWs Institute for Superconducting and Electronic Materials (ISEM) har med succes været banebrydende for en måde at konstruere en fleksibel, sammenfoldelig og let energilagringsenhed, der udgør bygges -
 Nanoshell-strukturer:Selvsamlingsmetoden giver materialer med unikke optiske egenskaberHeptamerer indeholdende syv nanoskaller har unikke optiske egenskaber. Kredit:Rice University Forskere fra fire amerikanske universiteter har skabt en måde at bruge Rice Universitys lysaktiverede
Nanoshell-strukturer:Selvsamlingsmetoden giver materialer med unikke optiske egenskaberHeptamerer indeholdende syv nanoskaller har unikke optiske egenskaber. Kredit:Rice University Forskere fra fire amerikanske universiteter har skabt en måde at bruge Rice Universitys lysaktiverede
- Ikke nu, aldrig nogensinde:Arbejder med vold i hjemmet
- Fordelene ved genbrug Copper
- Obligatorisk fjernundervisning kan mindske uligheden under pandemien – men det bliver svært at leve…
- Sådan beregnes gennemsnitlig dybde
- Google-tilknyttet firma vinder amerikansk godkendelse til droneleverancer
- Forskere udvikler ny software til at designe bæredygtige byer


