Byggeplads for molekylære komplekser
Ofte er summen større end dens dele. Ved at bruge et atomkraftmikroskop som en "kran", Forskere fra Ludwig Maximilian Universitetet i München er lykkedes med at bringe to biomolekyler sammen til et aktivt kompleks – med nanometerpræcision og indbygget kvalitetskontrol.
Den forretningsmæssige ende af atomkraftmikroskopet (AFM) er dets nåleskarpe spids. Det kan bruges til at vælge enkelte molekyler fra et substrat og flytte dem til bestemte positioner med en præcision på nogle få nanometer. Denne "single-molecule cut-and-paste" procedure blev udviklet af LMU fysiker professor Hermann Gaub, og han og hans kolleger har nu brugt det til at samle et funktionelt molekylært kompleks fra inaktive, enkeltmolekyle byggesten.
De byggede komplekset ud fra to korte RNA-strenge, at vælge en fra et depot hos AFM, og placere den tæt på den anden streng aflejret andetsteds på substratet. Når de to RNA-segmenter kommer i kontakt, de danner spontant det, der kaldes en "aptamer", en tredimensionel bindingslomme til et målmolekyle – i dette tilfælde det fluorescerende farvestof malakitgrøn. Bindingsinteraktionen forstærker fluorescensen udsendt af målet mere end 1000 gange - og signalerer, at de to dele af aptameren er samlet korrekt.
"Det vigtige er, at vi har præcis mekanisk kontrol over montageprocessen, ” siger hovedforfatter Mathias Strackharn. "Når vi ser det malakit-grønne signal i fluorescensmikroskopet, vi ved, at aptameren er blevet rekonstitueret med succes.” Forskerne er nu i stand til at konstruere andre systemer, hvis naturlige funktion afhænger af konfigurationen af deres molekylære komponenter. Dette vil sætte dem i stand til at dissekere, hvordan interaktioner mellem deres dele medierer funktionerne af molekylære komplekser.
 Varme artikler
Varme artikler
-
 Belægning af grafen med voks giver en mindre forurenet overflade under enhedens fremstillingBilledet til højre viser et grafenark belagt med voks under substratoverførselstrinnet. Denne metode reducerede drastisk rynker på grafenens overflade sammenlignet med en traditionel polymerbelægning
Belægning af grafen med voks giver en mindre forurenet overflade under enhedens fremstillingBilledet til højre viser et grafenark belagt med voks under substratoverførselstrinnet. Denne metode reducerede drastisk rynker på grafenens overflade sammenlignet med en traditionel polymerbelægning -
 Grafen ser lovende ud til fremtidige spintronic-enhederForskerne fremstillede spintronics-enhederne på Nano-fabrikationslaboratoriet på Chalmers University of Technology. Fra venstre:Saroj Prasad Dash, Venkata Kamalakar Mutta og André Dankert. Kredit:Osca
Grafen ser lovende ud til fremtidige spintronic-enhederForskerne fremstillede spintronics-enhederne på Nano-fabrikationslaboratoriet på Chalmers University of Technology. Fra venstre:Saroj Prasad Dash, Venkata Kamalakar Mutta og André Dankert. Kredit:Osca -
 En elektrificerende opdagelse:Nyt materiale til at høste elektricitet fra kropsbevægelserPiezo-gummi, supertynde film, der høster energi fra bevægelse, kan bæres på kroppen eller implanteres for at drive mobiltelefoner, hjertestartere, og anden elektronik i fremtiden. Kredit:Frank Wojcie
En elektrificerende opdagelse:Nyt materiale til at høste elektricitet fra kropsbevægelserPiezo-gummi, supertynde film, der høster energi fra bevægelse, kan bæres på kroppen eller implanteres for at drive mobiltelefoner, hjertestartere, og anden elektronik i fremtiden. Kredit:Frank Wojcie -
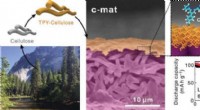 Plantecellulose forhindrer kortslutninger i batterierCellulose, der stammer fra plantemateriale, bruges som et tyndt lag i en ny separatormembran til batterier, hvilket resulterer i en stor stigning i kapacitetsbevarelse ved høje temperaturer. Kredit:Ki
Plantecellulose forhindrer kortslutninger i batterierCellulose, der stammer fra plantemateriale, bruges som et tyndt lag i en ny separatormembran til batterier, hvilket resulterer i en stor stigning i kapacitetsbevarelse ved høje temperaturer. Kredit:Ki
- Vindskæring påvirker tropisk storm Joyce i NASA-NOAA satellitbillede
- En Apple-pakke med Apple TV+, musik og nyheder kan være på vej
- Google-medarbejdere forlader arbejdet for at protestere mod behandling af kvinder
- Forskere skaber UV-aktiveret fleksibel, bærbar teknologi
- Når engelsk og fransk blandes i litteraturen
- Hvorfor er det en emoji? Etosen og fødselsprocessen bag de ikoner, vi bruger til at kommunikere


