Theranostic billeddannelse tilbyder metoder til at dræbe prostatacancerceller
(Phys.org) -- Eksperimenterer med humane prostatacancerceller og mus, kræftbilleddannelseseksperter hos Johns Hopkins siger, at de har udviklet en metode til at finde og dræbe ondartede celler, mens de skåner raske.
Metoden, kaldet teranostisk billeddannelse, målretter og sporer potente lægemiddelbehandlinger direkte og kun til kræftceller. Den er afhængig af at binde en oprindeligt inaktiv form for lægemiddelkemoterapi, med et enzym, til specifikke proteiner på tumorcelleoverflader og påvisning af lægemidlets absorption i tumoren. Bindingen af det meget specifikke lægemiddel-proteinkompleks, eller nanoplex, til celleoverfladen tillader det at komme ind i kræftcellen, hvor enzymet langsomt aktiverer det tumordræbende lægemiddel.
Forskere siger, at deres resultater, offentliggjort i tidsskriftet ACS Nano online 6. august, menes at være de første til at vise, at kemoterapier kan kontrolleres præcist på molekylært niveau for at maksimere deres effektivitet mod tumorer, samtidig med at de minimerer deres bivirkninger.
Seniorundersøgelsesforsker Zaver Bhujwalla, Ph.D., en professor ved Johns Hopkins University School of Medicine og dets Kimmel Cancer Center, bemærker, at et vedvarende problem med den nuværende kemoterapi er, at den angriber alle slags celler og væv, ikke kun kræftsyge.
I de theranostiske billeddiagnostiske eksperimenter, overvåget af Bhujwalla og studiemedforsker Martin Pomper, M.D., Ph.D., efterforskere rettede kun medicin mod kræftceller, specifikt dem med prostata-specifikt membranantigen, eller PSMA-celleoverfladeproteiner.
"Vores resultater viser en ikke-invasiv billeddannende tilgang til at følge og levere målrettet terapi til enhver cancer, der udtrykker PSMA, " siger Bhujwalla, som også fungerer som direktør for Johns Hopkins In Vivo Cellular and Molecular Imaging Center (ICMIC), hvor de theranostiske billeddannelsesstudier blev udviklet.
Bhujwalla siger, at den nye teknik potentielt vil virke mod enhver cancer, hvor tumorer øger produktionen af visse celleoverfladeproteiner. Eksempler vil omfatte brystkræft med HER-2/neu og CXCR4-proteiner, og noget lever, lunge- og nyrekræft, også kendt for at udtrykke bestemte proteiner. Hun bemærker, at PSMA udtrykkes i karrene i de fleste solide tumorer, tyder på, at nanoplexet rapporteret i den seneste undersøgelse generelt kan bruges til at afbilde og behandle en række kræftformer.
I deres seneste serie af eksperimenter, primært i mus injiceret med humane prostatatumorceller, Bhujwalla og Johns Hopkins-teamet testede deres evne til at spore leveringen af anti-cancer-lægemidler direkte til tumorer med billedbehandlingsenheder. Nogle af tumorerne bestod af celler med PSMA, mens andre såkaldte kontroltumorer ikke havde nogen. Inkluderet i lægemidlet nanoplex var små RNA-strenge, cellekonstruktionssyrer, der i stedet kan bruges til at blokere og skrue ned for produktionen af et velkendt enzym, cholin kinase, hvis niveauer normalt stiger med tumorvækst. Alle nanoplex-komponenter blev afbildet inde i tumoren, ud over at reducere produktionen af cholinkinase, som faldt med 80 procent inden for 48 timer efter nanoplex-absorption i celler med rigelig PSMA. Når forskere brugte antistoffer til at blokere virkningen af PSMA, ned gik niveauet af nanoplex-optagelse og lægemiddelaktivering i kræftceller målt ved dæmpning af billedet.
Forskellige koncentrationer af lægemidlet nanoplex, mærket med radioaktive og fluorescerende molekyler, blev blandet i laboratoriet med prostatacancervævsceller, hvoraf nogle havde ekstra PSMA og andre som ikke havde nogen. Kun de celler med ekstra PSMA viste nanoplex-optagelse, målt ved billedintensitet, som senere faldt, når PSMA-blokerende kemikalier blev tilsat (tilbage til niveauer set i celler med næsten ingen PSMA).
Yderligere eksperimenter, der involverede injektioner af tre forskellige koncentrationer af lægemidlet nanoplex, viste ingen skade på andre vitale museorganer, såsom nyre og lever, heller ikke nogen stigning i musens immunsystemrespons.
"Vores theranostiske billedbehandlingstilgang viser, hvordan de bedste metoder til påvisning og behandling kan kombineres til at danne højt specialiserede, mere potente og sikrere former for kemoterapi, " siger Pomper, en professor ved Johns Hopkins, der også fungerer som associeret direktør hos ICMIC.
Han siger, at et vigtigt mål for theranostisk billeddannelse er at flytte det ud over standard kemoterapi, der angriber et målmolekyle ad gangen. "Med teranostisk billeddannelse, vi kan angribe flere tumormål, gør det sværere for tumoren at undgå medicinbehandling, " siger Pomper, som allerede arbejder sammen med kolleger hos Johns Hopkins for at identificere andre molekylære mål.
 Varme artikler
Varme artikler
-
 Gentest i lægekontoretDenne engangspatron kan detektere genetiske variationer fra blodprøver. DNA isoleres fra hvide blodlegemer og fanges på et objektglas i patronen. Kredit:Nanosphere, Inc. (PhysOrg.com) -- Et bærbar
Gentest i lægekontoretDenne engangspatron kan detektere genetiske variationer fra blodprøver. DNA isoleres fra hvide blodlegemer og fanges på et objektglas i patronen. Kredit:Nanosphere, Inc. (PhysOrg.com) -- Et bærbar -
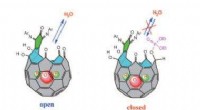 Forskere bygger verdens mindste vandflaskeEt åbent og lukket fullerenbur rummer et enkelt vandmolekyle. Billedkredit:Angewandte Chemie. Forskere har designet og bygget en beholder, der kun rummer et enkelt vandmolekyle. Beholderen består
Forskere bygger verdens mindste vandflaskeEt åbent og lukket fullerenbur rummer et enkelt vandmolekyle. Billedkredit:Angewandte Chemie. Forskere har designet og bygget en beholder, der kun rummer et enkelt vandmolekyle. Beholderen består -
 Fjernelse af farlige stoffer fra luften© Thinkstock Flygtige organiske forbindelser (VOCer) er kulstofbaserede forbindelser, hvoraf mange er sundhedsfarlige for mennesker. EU-finansierede forskere koordinerede indsatsen for at anvende
Fjernelse af farlige stoffer fra luften© Thinkstock Flygtige organiske forbindelser (VOCer) er kulstofbaserede forbindelser, hvoraf mange er sundhedsfarlige for mennesker. EU-finansierede forskere koordinerede indsatsen for at anvende -
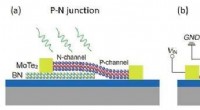 Fotodoping i 2-D materialer til fremstilling af logiske enhederFigur (a) og (b) viser den skematiske illustration af en p-n-forbindelse og en inverter, henholdsvis. Under lysbelysning og negative bias-forhold, lokaliserede positive ladninger efterlades i BN-laget
Fotodoping i 2-D materialer til fremstilling af logiske enhederFigur (a) og (b) viser den skematiske illustration af en p-n-forbindelse og en inverter, henholdsvis. Under lysbelysning og negative bias-forhold, lokaliserede positive ladninger efterlades i BN-laget
- Hvad er funktionsnotation?
- QMC -simuleringer afslører magnetiske egenskaber ved titaniumoxidmateriale
- Grøn nanosyn er nu en køreplan for udvikling
- NASAs næste rumteleskop lanceres i december
- Undersøgelse finder overraskende mangfoldighed i den tidlige børnepasning
- Effektive fluorescerende materialer og OLED'er til NIR


