Fotonisk-plasmonisk mikrokavitet til ultralydsfølsom proteindetektion
(Phys.org) -- Etiketfri optiske biosensorer muliggør overvågning af biomolekyler og deres interaktioner i ofte meget følsomme diagnostiske assays. Flere metoder er blevet brugt til dette formål, inklusive Whispering Gallery Mode (WGM) biosensing, som tilbyder en særlig følsom tilgang til at kvantificere massebelastningen af biomolekyler på resonatoroverfladen med ultimativ følsomhed estimeret på enkeltmolekyleniveau. Den enkleste WGM-biosensor er en glasmikrosfære (typisk 50-100 mm i diameter), hvor resonanslyset forbliver begrænset af total intern refleksion.
WGM-sensorer får deres hidtil usete følsomhed fra brugen af højkvalitetsfaktor (Q-faktor) optiske resonanser til at overvåge bølgelængdeforskydningssignaler ved binding af biomolekyler eller nanoperler til resonatoroverfladen. Selv en enkelt virus kunne påvises. Endnu, hvis f.eks. et enkelt proteinmolekyle skal påvises, følsomheden skal boostes. Der har været flere tilgange, såsom generering af hot spots ved hjælp af et hybrid fotonisk-plasmonisk sansekoncept med et guld nanopartikel (NP) lag koblet til en WGM biosensor. Imidlertid, der er nogle ulemper:For det første, målinger kan ikke udføres direkte i opløsning. Sekund, Realtidsanalyse er ikke mulig, da proteinerne skal præ-adsorberes på NP'erne. Tredje, proteiner adsorberes tilfældigt i NP-laget - uden for plasmoniske feltforstærkningssteder - hvilket sænker detektionsfølsomheden.
Et tysk-amerikansk hold ledet af Frank Vollmer og Melik C. Demirel foreslår nu et alternativt koncept, der overvinder disse problemer:optisk indfangning af proteinmolekyler på steder med plasmoniske feltforbedringer i et tilfældigt guld-NP-lag. Den stabile integration af mikrosfærens WGM-biosensor med et fugtet guld-NP-lag er afgørende for at opnå ultrafølsom detektion. Derfor, silica-mikrokuglehulrummet forbliver fikseret på Au NP-laget. Q-faktoren for mikrosfæren falder lidt, men er stadig i 105-intervallet. Efter tilsætning af bovint serumalbumin (BSA) opløsning i mikroliter prøvevolumener, som kommer ind i NP-laget ved kapillarsugning, forskerne observerede et uventet stort signifikant bølgelængdeskift.
Den opnåede følsomhed i størrelsesordenen femtomolkoncentrationsniveauer var meget overraskende, og kan ikke forklares ud fra tilfældig binding af BSA -molekylerne til NP -overfladen. I stedet, forskerne antog, at proteinmolekylerne foretrækker at binde sig til hotspot-lokationer (dvs. tæt anbragte tilfældige NP'er) af plasmonresonanser exciteret i NP-laget på grund af optisk fangst. For at validere denne hypotese, de beregnede den elektromagnetiske feltfordeling i et model NP-lag ved hjælp af generaliseret Mie-teori og simulerede den forventede bølgelængdeforskydning på grund af binding af proteiner. Deres beregninger viste, at Ja, optisk fangst af proteinerne på meget følsomme plasmoniske hotspot-steder er afgørende for at opnå høj følsomhed i mikrohulrumsbiosensing.
Den opnåede følsomhed i størrelsesordenen femtomolkoncentrationsniveauer var meget overraskende, og kan ikke forklares ud fra tilfældig binding af BSA-molekylerne til NP-overfladen. I stedet, forskerne antog, at proteinmolekylerne foretrækker at binde sig til hotspot-lokationer (dvs. tæt anbragte tilfældige NP'er) af plasmonresonanser exciteret i NP-laget på grund af optisk fangst. For at validere denne hypotese, de beregnede den elektromagnetiske feltfordeling i et model NP-lag ved hjælp af generaliseret Mie-teori og simulerede den forventede bølgelængdeforskydning på grund af binding af proteiner. Deres beregninger viste, at Ja, optisk fangst af proteinerne på meget følsomme plasmoniske hotspot-steder er afgørende for at opnå høj følsomhed i mikrohulrumsbiosensing.
Holdet, bestående af forskere ved Pennsylvania State University (USA), hos BASF SE (Ludwigshafen, Tyskland), Massachusetts Institute of Technology (Cambridge, USA), og Max Planck Institute for Science of Light (Erlangen, Tyskland), har etableret en ny lovende vej mod opløsning af enkelt molekyle i WGM-biosensorer koblet til konstruerede eller tilfældige plasmoniske nanoantenner. Brug af et tilfældigt NP-lag har fordelen ved integration til en mikrofluidisk enhed, og guld-NP'er kan let funktionaliseres med genkendelseselementer såsom oligonukleotider eller proteiner. Tilgangen kunne være af interesse for mange områder, herunder medicinsk biosensing og lægemiddelscreening.
 Varme artikler
Varme artikler
-
 Gennembrud i mikrofabrikation kunne sætte piezoelektriske materialeanvendelser i gangMikrobearbejdet hyperaktiv cantilever-struktur, der inkorporerer det gigantiske piezoresponsmateriale PMN-PT. Lavspændings gigantiske piezoelektriske respons inducerer mekanisk bevægelse af (PMN-PT) d
Gennembrud i mikrofabrikation kunne sætte piezoelektriske materialeanvendelser i gangMikrobearbejdet hyperaktiv cantilever-struktur, der inkorporerer det gigantiske piezoresponsmateriale PMN-PT. Lavspændings gigantiske piezoelektriske respons inducerer mekanisk bevægelse af (PMN-PT) d -
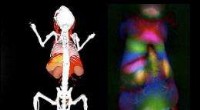 Bedre visning gennem fluorescerende nanorør, når du kigger ind i en musEt forbedret farvebillede af fluorescens fra enkeltvæggede kulstofnanorør (til højre) viser indre organer i en mus ved siden af en referenceillustration (venstre). På det fluorescerende billede, på
Bedre visning gennem fluorescerende nanorør, når du kigger ind i en musEt forbedret farvebillede af fluorescens fra enkeltvæggede kulstofnanorør (til højre) viser indre organer i en mus ved siden af en referenceillustration (venstre). På det fluorescerende billede, på -
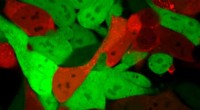 Rød glød hjælper med at identificere nanopartikler til levering af RNA-terapierCeller, der normalt er lysegrønne, bliver lyse røde, efter at lipidnanopartikler har leveret en mRNA-ladning, der koder for Cre. Celler, der er røde, indeholder mRNA, mens grønne celler ikke gør det.
Rød glød hjælper med at identificere nanopartikler til levering af RNA-terapierCeller, der normalt er lysegrønne, bliver lyse røde, efter at lipidnanopartikler har leveret en mRNA-ladning, der koder for Cre. Celler, der er røde, indeholder mRNA, mens grønne celler ikke gør det. -
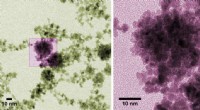 Nano-hindbær kunne bære frugt i brændselscellerFarvede mikrofotografier af platinnanopartikler lavet på NIST. Hindbærfarven antyder partiklernes bølgede form, som giver et stort overfladeareal til at katalysere reaktioner i brændselsceller. Indivi
Nano-hindbær kunne bære frugt i brændselscellerFarvede mikrofotografier af platinnanopartikler lavet på NIST. Hindbærfarven antyder partiklernes bølgede form, som giver et stort overfladeareal til at katalysere reaktioner i brændselsceller. Indivi
- Coronavirus kan få flyselskaber til at fusionere:AF-KLM-chef
- Hvad er nogle gode DNA-videnskabsprojekter?
- Hvordan man identificerer Texas Rocks
- Forkert udtale:Hvorfor du skal stoppe med at rette folks fejl
- Fysikere fryser krystal med 150 ioner
- New Mexico regulatorer OK massive vindmølleparker nær Texas


