Multitasking plasmoniske nanobubler dræber nogle celler, ændre andre
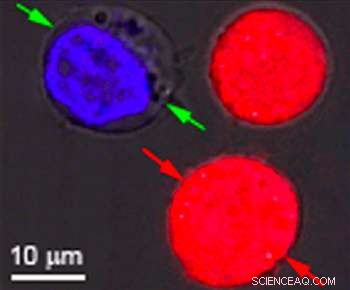
Identiske celler farvet rød og blå var målet for forskning ved Rice University for at vise effekten af plasmoniske nanobubbler. Boblerne dannes omkring opvarmede guldnanopartikler, der er målrettet mod bestemte celler, som kræftceller. Når partiklerne er hule, bobler dannes, der er store nok til at dræbe cellen, når de brister. Når partiklerne er faste, boblerne er mindre og kan slå et midlertidigt hul i en cellevæg, tillader medicin eller andet materiale at strømme ind. Begge effekter kan opnås samtidigt med en enkelt laserpuls. Kredit:Plasmonic Nanobubble Lab/Rice University
(Phys.org) - Forskere ved Rice University har fundet en måde at dræbe nogle syge celler og behandle andre i den samme prøve på samme tid. Processen aktiveret af en puls af laserlys efterlader tilstødende sunde celler uberørte.
Den unikke anvendelse til afstembare plasmoniske nanobobler udviklet i rislaboratoriet i Dmitri Lapotko viser løfte om at erstatte flere vanskelige processer, der nu bruges til behandling af kræftpatienter, blandt andre, med en hurtig, enkel, multifunktionel procedure.
Forskningen er i fokus i et papir, der i denne uge blev offentliggjort af American Chemical Society -tidsskriftet ACS Nano og blev udført på Rice af Lapotko, forsker og hovedforfatter Ekaterina Lukianova-Hleb og bachelorstuderende Martin Matonga, med bistand fra Center for celle- og genterapi ved Baylor College of Medicine (BCM), Texas Children's Hospital og University of Texas MD Anderson Cancer Center.
Plasmoniske nanobobler, der er 10, 000 gange mindre end et menneskehår forårsager små eksplosioner. Boblerne dannes omkring plasmoniske guldnanopartikler, der varmes op, når de ophidses af en ekstern energikilde - i dette tilfælde, en kort laserpuls - og fordamp et tyndt lag væske nær partikeloverfladen. Dampboblen ekspanderer hurtigt og falder sammen. Lapotko og hans kolleger havde allerede fundet ud af, at plasmoniske nanobobler dræber kræftceller ved bogstaveligt at eksplodere dem uden at skade raske naboer, en proces, der viste meget højere præcision og selektivitet sammenlignet med dem, der medieres af guld nanopartikler alene, han sagde.
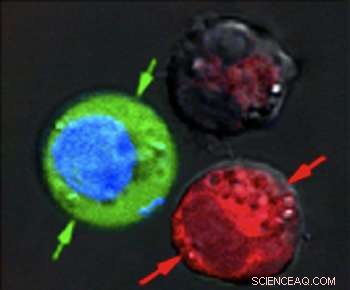
Efter laserpulsen, rødfarvede celler viser tegn på massiv skade fra eksploderende nanobobler, mens blåfarvede celler forblev intakte, men med grønt fluorescerende farvestof trukket ind udefra. Kredit:Plasmonic Nanobubble Lab/Rice University
Det nye projekt tager den bemærkelsesværdige evne et par skridt videre. En række eksperimenter viste, at en enkelt laserpuls skaber store plasmoniske nanobobler omkring hule guld nanoskaller, og disse store nanobobler ødelægger selektivt uønskede celler. Den samme laserpuls skaber mindre nanobobbler omkring nanosfærer i massivt guld, der slår en lillebitte, midlertidig pore i en celles væg og skabe et indgående nanojet, der hurtigt "injicerer" medicin eller gener i de andre celler.
I deres eksperimenter, Lapotko og hans team anbragte 60 nanometer brede hule nanoskaller i modelcancerceller og farvede dem røde. I en separat batch, de lagde 60 nanometer brede nanosfærer i den samme type celler og farvede dem blå.
Efter at have suspenderet cellerne sammen i et grønt fluorescerende farvestof, de affyrede en enkelt bred laserpuls mod den kombinerede prøve, vasket den grønne plet ud og kontrollerede cellerne under et mikroskop. De røde blodlegemer med de hule nanoshells blev sprængt fra hinanden af store plasmoniske nanobbler. De blå celler var intakte, men grønfarvet væske udefra var blevet trukket ind i cellerne, hvor mindre plasmoniske nanobubler omkring de nanopartikler i massivt guld midlertidigt åbnede væggene.
Fordi alt dette sker på en brøkdel af et sekund, så mange som 10 milliarder celler i minuttet kunne behandles selektivt i et gennemstrømningssystem som det under udvikling hos Rice, sagde Lapotko, en fakultet i biokemi og cellebiologi og i fysik og astronomi. Det har potentiale til at fremme celle- og genterapi og knoglemarvstransplantation, han sagde.
De fleste sygdomsbekæmpende celle- og genterapier kræver "ex vivo"-uden for kroppen-behandling af humane celletransplantater for at eliminere uønskede (som kræft) celler og genetisk modificere andre celler for at øge deres terapeutiske effektivitet, Sagde Lapotko. "Nuværende cellebehandling er ofte langsom, dyrt og arbejdskrævende og lider af høje celletab og dårlig selektivitet. Ideelt set bør både eliminering og transfektion (introduktion af materialer i celler) være yderst effektiv, selektiv, hurtigt og sikkert. "
Plasmonisk nanobobble -teknologi lover "en metode til at gøre flere ting til en cellepopulation på samme tid, "sagde Malcolm Brenner, professor i medicin og i pædiatri ved BCM og direktør for BCM's Center for Cell and Gene Therapy, der samarbejder med Rice -teamet. "For eksempel, hvis jeg vil putte noget ind i en stamcelle for at få det til at blive til en anden celletype, og samtidig dræbe omgivende celler, der har potentiale til at gøre skade, når de går tilbage til en patient - eller til en anden patient - har disse meget afstemmelige plasmoniske nanobubbler potentiale til at gøre det. "
Det langsigtede mål om en samarbejdsindsats blandt ris, BCM, Texas Children's Hospital og MD Anderson skal forbedre resultatet for patienter med sygdomme, hvis behandling kræver ex vivo cellebehandling, Sagde Lapotko.
Lapotko planlægger at bygge en prototype af teknologien med henblik på at teste med menneskelige celler i den nærmeste fremtid. "Vi vil gerne have, at dette er en universel platform for celle- og genterapi og for stamcelletransplantation, " han sagde.
 Varme artikler
Varme artikler
-
 Kopiering af gekkoers tæerKunstige hår på blot et par hundrede nanometer i diameter efterligner den klæbende overflade på en gekkos tåpuder. Kredit:Agency for Science, Teknologi og forskning Gekkoer er berømte for deres ev
Kopiering af gekkoers tæerKunstige hår på blot et par hundrede nanometer i diameter efterligner den klæbende overflade på en gekkos tåpuder. Kredit:Agency for Science, Teknologi og forskning Gekkoer er berømte for deres ev -
 Molekyler kunne skabe små kredsløb på computerchipsPolymermolekyler kan deponeres på computerchips, hvor de arrangerer sig selv i små mønstre som det, der er vist her. Kredit:Yeon Sik Jung og Joel Yang. (PhysOrg.com) -- Efterhånden som funktionern
Molekyler kunne skabe små kredsløb på computerchipsPolymermolekyler kan deponeres på computerchips, hvor de arrangerer sig selv i små mønstre som det, der er vist her. Kredit:Yeon Sik Jung og Joel Yang. (PhysOrg.com) -- Efterhånden som funktionern -
 Forskere integrerer enkeltkrystal BFO på en siliciumchip, åben dør til smarte enhederDette højopløselige TEM-mikrofotografi viser BFO dyrket på et siliciumsubstrat og justeret med en LSMO (lanthanum strontium manganoxid) elektrode. (Phys.org) —Forskere fra North Carolina State Uni
Forskere integrerer enkeltkrystal BFO på en siliciumchip, åben dør til smarte enhederDette højopløselige TEM-mikrofotografi viser BFO dyrket på et siliciumsubstrat og justeret med en LSMO (lanthanum strontium manganoxid) elektrode. (Phys.org) —Forskere fra North Carolina State Uni -
 Nyt elektronmikroskop udvider egenskaberne for karakterisering af materialer på laboratorietLawrence Livermore National Laboratory materialeforskere Joseph McKeown (venstre) og Tian (Tony) Li (højre) bruger det nye FEI Titan transmissionselektronmikroskop til at studere nanostrukturen og sam
Nyt elektronmikroskop udvider egenskaberne for karakterisering af materialer på laboratorietLawrence Livermore National Laboratory materialeforskere Joseph McKeown (venstre) og Tian (Tony) Li (højre) bruger det nye FEI Titan transmissionselektronmikroskop til at studere nanostrukturen og sam
- Forstå virkningen af defekter på egenskaberne af MoS2
- Højeffektive infrarøde fotodetektorer ved hjælp af guldnanoroder
- Billede:Evaluering af støjen fra fremtidige fly
- Sådan beregnes lineær vækst med Algebra
- Observationer kaster nyt lys på kosmisk mikrobølgebaggrund
- NASA:lad os sige noget til Voyager 1 på 40 -årsdagen for lanceringen


