Nanopartikler med proteinpas unddrager sig immunsystemet, levere mere medicin til tumorer
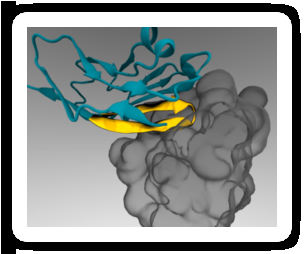
Et minimalt peptid-'pas' (gult) kan knyttes til terapeutiske nanopartikler, så det binder sig til en immuncellereceptor (grå) og forhindrer opslugning. Kredit:Diego Pantano
Forskere har fundet en måde at snige nanopartikler med tumorbekæmpende medicin forbi celler i immunsystemet, som normalt ville opsluge partiklerne, forhindre dem i at nå deres mål. Teknikken udnytter det faktum, at alle celler i menneskekroppen viser et protein på deres membraner, der fungerer som et specifikt 'pas' til at instruere immunceller om ikke at angribe dem. Ved at binde et lille stykke af dette protein til nanopartikler, forskere var i stand til at narre immunceller i mus til at genkende partiklerne som 'selv' i stedet for fremmede, hvorved mængden af medicin, der leveres til tumorer, øges.
Kræft nanoteknologi
Nuværende tilgange til kemoterapi efterlader patienter med alvorlige bivirkninger, fordi lægemidler mod kræft, der er beregnet til at ødelægge tumorer, utilsigtet dræber sunde celler i kroppen. Men videnskabsmænd har for nylig udviklet nanopartikler, der kan transportere giftig medicin direkte til tumorer, mens de skåner sundt væv. På grund af deres lille størrelse, nanopartikler undslipper fra utætte blodkar, der er karakteristiske for tumorer og ophobes i kræftvævet. Tumorceller optager partiklerne, som frigiver deres giftige indhold, når de først er inde. Dette lokaliserede leveringssystem gør det muligt for læger at give patienter højere doser af medicin, end de normalt ville blive tolereret.
Tidligere forsøg er blevet gjort på at afværge angreb fra immunsystemet ved at belægge nanopartikler tæt med polyethylenglycol (PEG) "børster", der fysisk blokerer vedhæftningen af proteiner, der normalt aflejres på fremmedlegemer for at tiltrække makrofager. Mens disse børster forsinker starten af immunresponset, de forhindrer det ikke.
Inspirationen til Dischers gennembrudsarbejde går tretten år tilbage, da en gruppe forskere med gensplejsede mus viste, at et protein kaldet CD47 - som findes i cellemembranerne hos næsten alle pattedyr - interagerer med en receptor på makrofager kaldet SIRPa, og, derved, signalerer, at cellen er hjemmehørende og ikke bør ødelægges. Resultaterne var afhængige af sletning af mus CD47 og rejste mange spørgsmål, herunder hvordan sådanne mus overlever, og om der var relevans for mennesker.
Discher, som udviklede nanopartikler, der selv samles i forskellige former på tidspunktet for opdagelsen, indså, at CD47-SIRPa-mekanismen til selvgenkendelse kunne, i princippet, udnyttes til at hjælpe nanopartikler med at snige sig forbi immunsystemet. Men det var også klart, at menneskelige versioner af oprensede proteiner skulle undersøges for enhver oversættelse til mennesker.
I 2008 Dischers laboratorium viste, at human CD47 virker på samme måde som mus CD47 som en "markør for sig selv" via signalering gennem SIRPa-receptoren. Kort derefter, en gruppe forskere belyst den kombinerede struktur af human CD47 og SIRPa i atomare detaljer. Dischers laboratorium brugte disse oplysninger til at udføre computersimuleringer og identificere den mindste del af CD47, der stadig kunne binde til SIRPa. Resultatet var et kort peptid, som Dischers laboratorium syntetiserede kemisk og fæstnet til standard nanopartikler.
"Reduktion af CD47 til et essentielt peptid var et nøgletrin, " sagde Discher. "Sekventering af tusindvis af menneskelige genomer rundt om i verden har for nylig afsløret mange variationer i sekvenserne af CD47 og SIRPa. Vi havde brug for at konstruere et 'universelt' peptid, der kunne binde SIRPa og fungere i alle mennesker på trods af disse forskelle."
Stealth-nanopartikler undgår immunrespons
For at teste, om deres peptid kunne hjælpe nanopartikler med at undgå immunsystemet, Dischers team injicerede både peptidbundne nanopartikler og nanopartikler, der mangler CD47, i mus. Begge typer nanopartikler indeholdt et fluorescerende farvestof, der gjorde det muligt for forskerne at spore partiklerne. I en artikel offentliggjort den 22. februar, 2013 i Videnskab , forskerne rapporterede, at på kun tredive minutter efter injektion af partiklerne, musenes blod indeholdt fire gange så mange nanopartikler indeholdende CD47-peptid som partikler uden peptidet, hvilket tyder på, at CD47-bundne partikler blev set af makrofager som lignende celler, der hørte til i kroppen.
Opmuntret af disse første resultater, holdet fyldte derefter deres CD47-bundne nanopartikler, samt PEG-coatede nanopartikler uden CD47, med kræftlægemidlet paclitaxel plus et tumor-målrettet antistof. Holdet injicerede separat begge typer nanopartikler såvel som Cremophore - standardbæreren for paclitaxel - i mus med menneskelignende tumorer. Efter blot en dag, tumorerne i mus injiceret med CD47-bundne nanopartikler var 70 % af størrelsen af dem, der blev injiceret med de PEG-coatede nanopartikler. Derudover CD47-bundne nanopartikler var lige så gode eller bedre til at formindske tumorerne som Cremophore uden at forårsage bivirkninger. Holdet fortsatte med at dokumentere de molekylære ændringer, der opstår inde i makrofager, når CD47 hæmmer opslugning, tyder på, at yderligere medicin kan bruges til at hæmme clearance.
"Kliniske forsøg med nanopartikler til at levere kræftlægemidler er i øjeblikket i gang, men immunsystemets clearance er fortsat en betydelig hindring, " sagde Karen Peterson, Ph.D., Seniorrådgiver for ekstramurale programmer hos NIBIB. "Dischers arbejde er en elegant tilgang, som kunne gøre det muligt for andre nanoterapeutika at være effektive i kliniske forsøg ved at give en molekylær "godkendelse", som kroppen ikke genkender som fremmed."
Peterson bemærkede også kombinationen af bioteknik og computermodellering, der gik med til at generere peptidet; Dischers evne til at teste funktionen af peptider af forskellig størrelse via computersimulering først, og derefter producere et menneskeskabt peptid baseret på disse simuleringer gjorde det muligt for ham at eliminere noget af gættespillet, sparer tid og penge i det lange løb.
Fremtidige ansøgninger
Discher spekulerer i, at hans CD47-peptid på samme måde kan bruges til at forhindre immunclearance af vira, der bruges til at levere gener til genterapibehandling eller til at øge biokompatibiliteten og holdbarheden af større fremmedlegemer såsom pacemakere og implantater, hvis dele kan nedbrydes over tid på grund af angreb fra immunsystemet.
 Varme artikler
Varme artikler
-
 Svært at strække silicium bliver superelastiskIllustration af væksten af strækbare silicium nanotråde. Kredit:Xue et al. © 2017 American Chemical Society Som et hårdt og sprødt materiale, silicium har praktisk talt ingen naturlig elasticite
Svært at strække silicium bliver superelastiskIllustration af væksten af strækbare silicium nanotråde. Kredit:Xue et al. © 2017 American Chemical Society Som et hårdt og sprødt materiale, silicium har praktisk talt ingen naturlig elasticite -
 Clathrin som et bioteknisk substrat:Immobilisering og funktionaliseringMontering af clathrin gitter på forskellige overflader. Kredit:(c) 2015 Naturnanoteknologi , DOI:10.1038/NNANO.2015.206 (Phys.org)-Baseparringsegenskaberne for DNA, kombineret med vores evner ti
Clathrin som et bioteknisk substrat:Immobilisering og funktionaliseringMontering af clathrin gitter på forskellige overflader. Kredit:(c) 2015 Naturnanoteknologi , DOI:10.1038/NNANO.2015.206 (Phys.org)-Baseparringsegenskaberne for DNA, kombineret med vores evner ti -
 Nanorør-kompositter øger effektiviteten af næste generation af solcellerKulstof nanorør bliver stadig mere attraktive for solceller som erstatning for silicium. Forskere ved Umeå Universitet i Sverige har opdaget, at kontrolleret placering af kulstofnanorørene i nanostruk
Nanorør-kompositter øger effektiviteten af næste generation af solcellerKulstof nanorør bliver stadig mere attraktive for solceller som erstatning for silicium. Forskere ved Umeå Universitet i Sverige har opdaget, at kontrolleret placering af kulstofnanorørene i nanostruk -
 En blanding af bittesmå guld- og viruspartikler - og de DNA-bånd, der binder demKrystalgitter skabt af Sung Yong Park og kolleger (Illustration af Adolf Lachman) Forskere har skabt et diamantlignende gitter bestående af guld nanopartikler og virale partikler, vævet sammen og
En blanding af bittesmå guld- og viruspartikler - og de DNA-bånd, der binder demKrystalgitter skabt af Sung Yong Park og kolleger (Illustration af Adolf Lachman) Forskere har skabt et diamantlignende gitter bestående af guld nanopartikler og virale partikler, vævet sammen og
- Sjældne jordarter låser kobber op, guld og sølv hemmeligheder
- Videnskabelige lektionsplaner på dyr i første klasse
- Sådan måles sukkerindholdet med en laserpeger
- Beskytter vi virkelig floder og vandløb mod forurening? Det er svært at sige, og det er et problem
- Havkraft:En grøn mulighed, der ikke laver bølger
- Atomomskiftere:Ionisk databehandling


