Varme nanopartikler til kræftbehandlinger
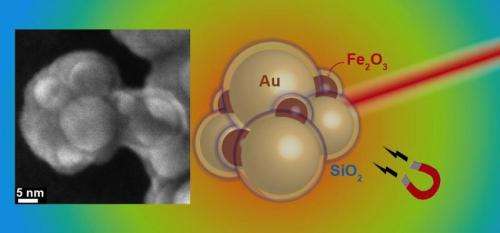
Skema af guld- og jernoxidaggregater med silica skal. Til venstre:elektronmikroskopisk billede af et aggregat. Kredit:Georgios Sotiriou / ETH Zürich
Nanopartikler har et stort potentiale inden for medicin:til diagnostik, som et redskab til aktive stoffer eller et redskab til at dræbe tumorer ved hjælp af varme. ETH Zürich -forskere har nu udviklet partikler, der er relativt lette at producere og har en lang række anvendelser.
Hvis du lægger din hånd over en tændt brænder i mørket, det ser ud til at lyse rødt. Dette skyldes, at røde lysstråler med lang bølgelængde trænger mere effektivt ind i menneskeligt væv end blåt lys med kort bølgelængde. ETH Zürich-forskere udnytter denne kendsgerning i en ny slags nanopartikler:såkaldte plasmoniske partikler, som varmes op, når de absorberer nær-infrarødt lys. Dette kan gøre dem i stand til at dræbe tumorvæv med varme, for eksempel.
Guld er et populært materiale til nanopartikler, der anvendes terapeutisk, da det tolereres godt og normalt ikke udløser uønskede reaktioner. I den karakteristiske kugle- eller kugleform af nanopartikler, imidlertid, guld har ikke de nødvendige egenskaber til at fungere som en plasmonisk partikel, der absorberer tilstrækkeligt i det nær-infrarøde lysspektrum til opvarmning. For at gøre det, det skal støbes til en særlig form, såsom en stang eller skal, så guldatomer vedtager en konfiguration, der begynder at absorbere nær-infrarødt lys, derved generere varme. Fremstilling af sådanne nanoroder eller nanoshells i tilstrækkelige mængder, imidlertid, er kompleks og dyr.
Aggregater i stedet for stænger
Et team af forskere under ledelse af Sotiris Pratsinis, Professor i partikelteknologi ved ETH Zürich, har nu opdaget et trick til at fremstille plasmoniske guldpartikler i store mængder. De brugte deres eksisterende knowhow på plasmoniske nanopartikler og lavede kugleformede guld-nanopartikler, der viser de ønskede nær-infrarøde plasmoniske egenskaber ved at tillade dem at blive aggregeret. Hver partikel er på forhånd belagt med et siliciumdioxidlag, som fungerer som en pladsholder mellem de enkelte sfærer i aggregatet. Gennem den præcist definerede afstand mellem flere guldpartikler, forskerne omdanner partiklerne til en konfiguration, der absorberer nær-infrarødt lys og dermed genererer varme.
"Siliciumdioxidskallen har en anden fordel", forklarer Georgios Sotiriou, første forfatter på undersøgelsen, og indtil for nylig, en postdoc i Pratsinis 'forskningsgruppe og i øjeblikket en Swiss National Science Foundation Fellow ved Harvard University:"Det forhindrer partiklerne i at deformere, når de varmes op." Dette er et stort problem med nanoroder. Hvis stængerne mister deres form under opvarmning, de mister deres ønskede plasmoniske egenskaber og er ikke længere i stand til at absorbere nok nær-infrarødt lys til at generere varme.
Forskerne har allerede testet de nye partikler på brystkræftceller i en petriskål og opdaget, at efter eksponering for nær-infrarødt lys opvarmede nanopartiklerne tilstrækkeligt til at dræbe cellerne, mens celler overlevede i kontrolforsøg (med partikler men uden stråling og med stråling men uden nanopartikler).
Kombination med stort potentiale
For at kunne styre partiklerne specifikt mod kræftvæv, forskerne blandede også superparamagnetiske jernoxidpartikler ind med guldpartiklerne, som gør det muligt at kontrollere nanoaggregaterne via magnetfelter og kan øge deres akkumulering i en tumor. I øvrigt, dette åbner mulighed for opvarmning af aggregaterne i dybe lag af væv, som infrarødt lys ikke længere kan nå via magnetisk hypertermi. Her, opvarmning af partiklerne induceres af et magnetfelt, hvor plus- og minuspolerne veksler hurtigt.
"Mange spørgsmål mangler stadig at blive besvaret, før partiklerne kan bruges til mennesker", siger Jean-Christophe Leroux, Professor i lægemiddelformulering og levering ved ETH Zürich, som også var involveret i forskningsprojektet. Selvom guld, siliciumdioxid og jernoxid tolereres godt, hvad der sker med partikelaggregaterne i kroppen i løbet af tiden - uanset om de akkumuleres i leveren eller nedbrydes og udskilles, for eksempel - mangler stadig at blive undersøgt.
Hybridjernoxid-guld-nanopartiklerne er ikke kun i stand til at dræbe tumorceller gennem varme; de kan også bruges som kontrastmedium til billeddannelsesprocesser i diagnostik ved hjælp af magnetisk resonansbilleddannelse, som undersøgt i samarbejde med University Hospital Zurich, eller som en del af et køretøj, der bærer aktive stoffer. "Du kan endda forbinde partiklerne med temperaturfølsomme lægemiddelbærere, som derefter ville tillade frigivelse af lægemidlet, hvis en bestemt temperatur blev overskredet ", forklarer Sotiriou. Dette ville tillade uønskede bivirkninger på resten af kroppen at blive reduceret eller endda undgås.
 Varme artikler
Varme artikler
-
 Grafen kan være nøglen til at kontrollere vandfordampningenDenne visualisering viser lag af grafen, der bruges til membraner. Kredit:University of Manchester Grafenbelægninger kan give mulighed for at kontrollere vandfordampningsprocessen fra forskellige
Grafen kan være nøglen til at kontrollere vandfordampningenDenne visualisering viser lag af grafen, der bruges til membraner. Kredit:University of Manchester Grafenbelægninger kan give mulighed for at kontrollere vandfordampningsprocessen fra forskellige -
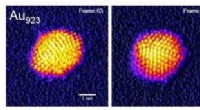 Atomstruktur af nanopartikler bragt under kontrolBillede:Professor Richard E Palmer / University of Birmingham Nanoteknologer er kontrolfreaks. De ønsker at udnytte materialernes egenskaber på det ultimative niveau – atomerne. Forestil dig frus
Atomstruktur af nanopartikler bragt under kontrolBillede:Professor Richard E Palmer / University of Birmingham Nanoteknologer er kontrolfreaks. De ønsker at udnytte materialernes egenskaber på det ultimative niveau – atomerne. Forestil dig frus -
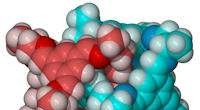 Liverpool-forskere konstruerer molekylære knuderDe molekylære knuder har dimensioner på omkring to nanometer Forskere ved University of Liverpool har konstrueret molekylære knuder med dimensioner på omkring to nanometer - omkring 30, 000 gange
Liverpool-forskere konstruerer molekylære knuderDe molekylære knuder har dimensioner på omkring to nanometer Forskere ved University of Liverpool har konstrueret molekylære knuder med dimensioner på omkring to nanometer - omkring 30, 000 gange -
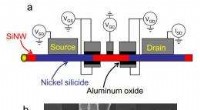 Fysik -teamet udtænker en måde at lave den første udopede silicon -nanotrådslåge påa) Skematisk af en multi-gate-enhed fremstillet af en enkelt, udopet SiNW. To viklingsporte, mærket som GS og GD, er designet til at styre Schottky -barrierer ved silicidesiliciumkrydsene dannet af ki
Fysik -teamet udtænker en måde at lave den første udopede silicon -nanotrådslåge påa) Skematisk af en multi-gate-enhed fremstillet af en enkelt, udopet SiNW. To viklingsporte, mærket som GS og GD, er designet til at styre Schottky -barrierer ved silicidesiliciumkrydsene dannet af ki
- Forskere finder stratificeret struktur i bred linjeregion for aktive galaktiske kerner i skiftende u…
- Ny basalttype opdaget under havet
- Låser op for universets hemmeligheder
- Sensornetværk har til formål at måle kuldioxid- og forureningsniveauer i Los Angeles
- Caribiske koralrevs tilbagegang begyndte i 1950'erne og 1960'erne fra lokale menneskelige aktivitete…
- $ 5-tn brændstofefterforskningsplaner, der er uforenelige med klimamål


