Aminosyrefingeraftryk afsløret i ny undersøgelse
Stuart Lindsay er direktør for Center for Single Molecule Biophysics ved Biodesign Institute ved Arizona Arizona State University. Kredit:Biodesign Institute ved Arizona State University
Omkring tre milliarder basepar udgør det menneskelige genom - livets grundplan. I 2003, Human Genome Project annoncerede den vellykkede dekryptering af denne kode, en tour de force, der fortsætter med at levere en strøm af indsigter, der er relevante for menneskers sundhed og sygdom.
Alligevel, de primære aktører i stort set alle livsprocesser er de proteiner, der kodes for af DNA-sekvenser kendt som gener. For et bredt spektrum af sygdomme, proteiner kan give langt mere overbevisende åbenbaringer, end der kan hentes fra DNA alene, hvis forskerne kan nå at låse op for de aminosyresekvenser, de er sammensat af.
Nu, Stuart Lindsay og hans kolleger ved Arizona State University's Biodesign Institute har taget et stort skridt i denne retning, demonstrere den nøjagtige identifikation af aminosyrer, ved kortvarigt at fastgøre hver i en snæver forbindelse mellem et par flankerende elektroder og måle en karakteristisk kæde af strømspidser, der passerer gennem successive aminosyremolekyler.
Ved at bruge en maskinlæringsalgoritme, Lindsay og hans team var i stand til at træne en computer til at genkende udbrud af elektrisk aktivitet, der repræsenterer den øjeblikkelige binding af en aminosyre i krydset. Støjsignalerne blev vist at fungere som pålidelige fingeraftryk, identificere aminosyrer, inklusive subtilt modificerede varianter.
Proteiner leverer allerede et væld af oplysninger, der er relevante for sygdomme, herunder kræft, diabetes og neurologiske lidelser som Alzheimers, samt at give nøgleindsigt i en anden proteinmedieret proces:aldring.
Det nye arbejde fremmer udsigten til klinisk proteinsekventering og opdagelsen af nye biomarkører - tidlige varslingssignaler, der signalerer sygdom. Yderligere, proteinsekventering kan radikalt transformere patientbehandling, muliggør præcis overvågning af sygdomsrespons på terapeutika, på molekylært niveau.
Gruppens forskningsresultater er rapporteret i den avancerede onlineudgave af tidsskriftet Natur nanoteknologi .
Fra genom til proteom
Et enormt bibliotek af proteiner - kendt som proteomet, indtager en central scene i stort set alle livsprocesser. Proteiner er afgørende for cellulær vækst, differentiering og reparation; de katalyserer kemiske reaktioner og yder forsvar mod sygdom, blandt utallige husholdningsfunktioner.
En af de mærkeligste overraskelser, der dukker op fra Human Genome Project, er det faktum, at kun omkring 1,5 procent af genomet koder for proteiner. Resten af DNA-nukleotiderne danner regulatoriske sekvenser, ikke-kodende RNA-gener, introner, og ikke-kodende DNA, (engang hånligt mærket "junk-DNA"). Dette efterlader mennesker med et sparsomt 20-25, 000 gener, en nøgtern opdagelse i betragtning af, at den ringe rundorm har nogenlunde det samme antal. Som professor Lindsay bemærker, nyheden bliver værre:"En liljeplante har omkring en størrelsesorden flere gener end vi gør, " han siger.
Mysteriet med komplekse organismer som mennesker, der bærer et forfærdeligt lavt gental, har at gøre med det faktum, at proteiner genereret fra DNA-planen kan modificeres på en række måder. Faktisk, videnskabsmænd har allerede identificeret over 100, 000 menneskelige proteiner og forskere som Lindsay mener, at dette måske kun er toppen af isbjerget.
Ligesom sætninger kan få deres betydning ændret gennem ændringer i ordrækkefølge eller tegnsætning, proteiner genereret fra genskabeloner kan ændre funktion (eller nogle gange blive gjort ubrugelige), ofte med alvorlige konsekvenser for menneskers sundhed. To nøgleprocesser, der modificerer proteiner, er kendt som alternativ splejsning og post-translationel modifikation. De er drivkræfterne bag den observerede ekstraordinære proteinvariation.
Alternativ splejsning forekommer, når der koder regioner af RNA, (kendt som exoner) splejses sammen, og ikke-kodende områder (kendt som introner) klippes ud, før oversættelse til proteiner. Denne proces foregår ikke altid pænt, med lejlighedsvise overlapninger af exoner eller introner, der introduceres, producerer alternativt splejsede proteiner, hvis funktion kan ændres.
Post-translationelle modifikationer er markører tilføjet efter proteiner er blevet lavet. Der er mange former for post-translationel modifikation, herunder methylering og phosphorylering. Nogle ændrede proteiner udfører vitale funktioner, mens andre kan være afvigende og forbundet med sygdom (eller sygdomstilbøjelighed). En række kræftformer er forbundet med sådanne proteinfejl, som allerede bruges som diagnostiske markører. Korrekt identifikation af sådanne proteiner er dog fortsat en stor udfordring inden for biomedicin.
Nye sekvenser
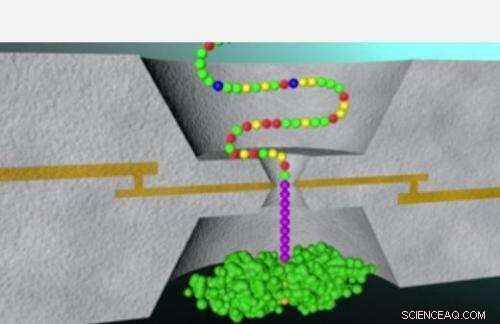
Teknikken beskrevet i den nuværende forskning blev tidligere anvendt i Lindsay-laboratoriet til succesfuld sekventering af DNA-baser. Denne metode - kendt som genkendelsestunneling - involverer at føre et peptid gennem et lille øje, kendt som en nanopore. Et par metalelektroder, adskilt af et mellemrum på cirka to nanometer, sidder på hver side af nanoporen, da successive enheder af et peptid føres gennem den lille åbning, med hver enhed, der fuldfører et elektrisk kredsløb og udsender en byge af strømspidser.
Forskergruppen viste, at tætte analyser af disse nuværende spidser kunne gøre det muligt for forskere at bestemme, hvilken af de fire nukleotidbaser - adenin, thymin, cytosin eller guanin - var placeret mellem elektroderne i nanoporen.
"For omkring 2 år siden i et af vores laboratoriemøder, det blev foreslået, at den samme teknologi måske ville fungere for aminosyrer, " siger Lindsay. Således begyndte bestræbelserne på at tackle den væsentligt større udfordring ved at bruge genkendelsestunneling til at identificere alle 20 aminosyrer, der findes i proteiner, i modsætning til kun 4 baser, der omfatter DNA.
Enkeltmolekyle sekventering af proteiner er af enorm værdi, giver mulighed for at detektere aftagende små mængder af proteiner, der kan være blevet justeret ved alternativ splejsning eller post-translationel modifikation. Tit, these are the very proteins of interest from the standpoint of recognizing disease states, though current technologies are inadequate to detect them.
As Lindsay notes, there is no equivalent in the protein world to polymerase chain reaction (PCR) technology, which allows minute quantities of DNA in a sample to be rapidly amplified. "We probably don't even know about most of the proteins that would be important in diagnostics. It's just a black hole to us because the concentrations are too low for current analytical techniques, " han siger, adding that the ability of recognition tunneling to pinpoint abnormalities on a single molecule basis "could be a complete game changer in proteomics."
The new paper describes a series of experiments in which pure samples of individual amino acids, individual molecules in mixed solution and finally, short peptide chains were successfully identified through recognition tunneling. The work sets the stage for a method to sequence individual protein molecules rapidly and cheaply (see accompanying animation).
A machine learning algorithm known as Support Vector Machine was used to train a computer to analyze the burst signals produced when amino acids formed bonds in the tunnel junction and emitted a lively noise signal as the poised electrodes passed tunneling current through each molecule. (The machine learning algorithm is the same one used by the IBM computer 'Watson' to defeat a human opponent in Jeopardy.)
Lindsay says that around 50 distinct signal burst characteristics were used in the amino acid identifications, but that most of the discriminatory power is achieved with 10 or fewer signal traits.
Bemærkelsesværdigt, recognition tunneling not only pinpointed amino acids with high reliability from single complex burst signals, but managed to distinguish a post-translationally modified protein (sarcosine) from its unmodified precursor (glycine) and also to discriminate between mirror-image molecules knows as enantiomers and so-called isobaric molecules, which differ in peptide sequence but exhibit identical masses.
Pathway to the $1000 dollar proteome?
Lindsay indicates that the new studies, which rely on innovative strategies for handling single molecules coupled with startling advances in computing power, open up horizons that were inconceivable only a short time ago. It is becoming clear that the tools that made the $1000 genome feasible are equally applicable to an eventual $1000 dollar proteome. Ja, such a landmark may not be far off. "Why not?" Lindsay asks. "People think it's crazy but the technical tools are there and what will work for DNA sequencing will work for protein sequencing."
While the tunneling measurements have until now been made using a complex laboratory instrument known as a scanning tunneling microscope (STM), Lindsay and his colleagues are currently working on a solid state device capable of fast, cost-effective and clinically applicable recognition tunneling of amino acids and other analytes. Eventual application of such solid-state devices in massively parallel systems should make clinical proteomics a practical reality.
 Varme artikler
Varme artikler
-
 Minste harddisk til dato skriver information atom for atomSTM -scanning (96 nm bred, 126 nm høj) af 1 kB hukommelse, skrevet til et afsnit af On the Origin of Species af Charles Darwin (uden tekstmærkning). Kredit:Ottelab/TUDelft Hver dag, det moderne sa
Minste harddisk til dato skriver information atom for atomSTM -scanning (96 nm bred, 126 nm høj) af 1 kB hukommelse, skrevet til et afsnit af On the Origin of Species af Charles Darwin (uden tekstmærkning). Kredit:Ottelab/TUDelft Hver dag, det moderne sa -
 Nanoskala guldpartikler er gode kandidater til levering af lægemidlerMIT -ingeniører skabte simuleringer af, hvordan en guld -nanopartikel belagt med specielle molekyler kan trænge igennem en membran. Til venstre, partiklen (øverst) får kontakt med membranen. Til højre
Nanoskala guldpartikler er gode kandidater til levering af lægemidlerMIT -ingeniører skabte simuleringer af, hvordan en guld -nanopartikel belagt med specielle molekyler kan trænge igennem en membran. Til venstre, partiklen (øverst) får kontakt med membranen. Til højre -
 Citrat nøgle i knoglers nanostrukturDette diagram viser effekten af citratkoncentration på størrelsen af hydroxyapatitkrystaller fremstillet med selvsamlende blokcopolymerskabeloner. Ligesom det gør med den faktiske knoglestruktur,
Citrat nøgle i knoglers nanostrukturDette diagram viser effekten af citratkoncentration på størrelsen af hydroxyapatitkrystaller fremstillet med selvsamlende blokcopolymerskabeloner. Ligesom det gør med den faktiske knoglestruktur, -
 Magnetisk styret batteri kan lagre energi til elnetBilleder af magnetvæsken indeholdende superparamagnetiske nanopartikler, der bevæger sig med et påført magnetfelt. (e) viser farveforskellen mellem en ren polysulfidopløsning uden magnetiske nanoparti
Magnetisk styret batteri kan lagre energi til elnetBilleder af magnetvæsken indeholdende superparamagnetiske nanopartikler, der bevæger sig med et påført magnetfelt. (e) viser farveforskellen mellem en ren polysulfidopløsning uden magnetiske nanoparti
- Hvad blev Silt brugt til i det gamle Egypten?
- Forskning ser på materialets friktionsegenskaber
- Forskere vurderer mulige scenarier for økologiske tjenester i Three-River-Source-regionen
- Klassifikation af vulkaner
- Tysk robotteknologi skal krympe for første gang i årti
- Ny teknologi forbedrer gravitationsbølgedetektorer ved at reducere kvantestøj


