Nanoskala guldpartikler er gode kandidater til levering af lægemidler
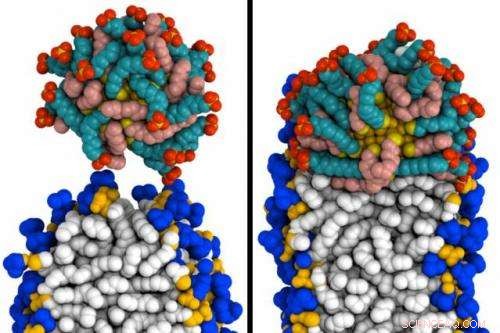
MIT -ingeniører skabte simuleringer af, hvordan en guld -nanopartikel belagt med specielle molekyler kan trænge igennem en membran. Til venstre, partiklen (øverst) får kontakt med membranen. Til højre, det har smeltet til membranen. Kredit:Reid Van Lehn
En særlig klasse af små guldpartikler kan let glide gennem cellemembraner, gør dem til gode kandidater til at levere medicin direkte til målceller.
En ny undersøgelse fra MIT-materialeforskere afslører, at disse nanopartikler kommer ind i celler ved at drage fordel af en rute, der normalt bruges i vesikel-vesikelfusion, en afgørende proces, der tillader signaloverførsel mellem neuroner. I udgaven af 21. juli af Naturkommunikation , forskerne beskriver detaljeret den mekanisme, hvormed disse nanopartikler er i stand til at smelte sammen med en membran.
Resultaterne tyder på mulige strategier til at designe nanopartikler - fremstillet af guld eller andre materialer - der endnu lettere kan komme ind i cellerne.
"Vi har identificeret en type mekanisme, der kan være mere udbredt, end man i øjeblikket kender, "siger Reid Van Lehn, en MIT -kandidatstuderende i materialevidenskab og teknik og en af papirets hovedforfattere. "Ved at identificere denne vej for første gang foreslår det også ikke kun, hvordan man konstruerer denne særlige klasse af nanopartikler, men at denne vej også kan være aktiv i andre systemer. "
Papirets anden hovedforfatter er Maria Ricci fra École Polytechnique Fédérale de Lausanne (EPFL) i Schweiz. Forskergruppen, ledet af Alfredo Alexander-Katz, lektor i materialevidenskab og teknik, og Francesco Stellacci fra EPFL, omfattede også forskere fra Carlos Besta Institute of Neurology i Italien og Durham University i Det Forenede Kongerige.
De fleste nanopartikler kommer ind i celler gennem endocytose, en proces, der fælder partiklerne i intracellulære rum, som kan beskadige cellemembranen og få celleindhold til at lække ud. Imidlertid, i 2008, Stellacci, hvem var dengang på MIT, og Darrell Irvine, professor i materialevidenskab og teknik og biologisk teknik, fandt ud af, at en særlig klasse af guldnanopartikler belagt med en blanding af molekyler kunne trænge ind i celler uden forstyrrelser.
"Hvorfor det skete, eller hvordan dette skete, var et fuldstændigt mysterium, "Siger Van Lehn.
Sidste år, Alexander-Katz, Van Lehn, Stellacci, og andre opdagede, at partiklerne på en eller anden måde fusionerede med cellemembraner og blev absorberet i cellerne. I deres nye undersøgelse, de skabte detaljerede atomistiske simuleringer for at modellere, hvordan dette sker, og udførte eksperimenter, der bekræftede modellens forudsigelser.
Stealth indgang
Guldnanopartikler, der bruges til levering af lægemidler, er normalt belagt med et tyndt lag af molekyler, der hjælper med at justere deres kemiske egenskaber. Nogle af disse molekyler, eller ligander, er negativt ladede og hydrofile, mens resten er hydrofobe. Forskerne fandt ud af, at partiklernes evne til at komme ind i celler afhænger af interaktioner mellem hydrofobe ligander og lipider, der findes i cellemembranen.
Cellemembraner består af et dobbelt lag af phospholipidmolekyler, som har hydrofobe lipidhaler og hydrofile hoveder. Lipidhalerne vender ind mod hinanden, mens de hydrofile hoveder vender ud.
I deres computersimuleringer, forskerne skabte først det, de kalder et "perfekt dobbeltlag, "hvor alle lipidhalerne forbliver på plads i membranen. Under disse betingelser, forskerne fandt ud af, at guldnanopartiklerne ikke kunne smelte sammen med cellemembranen.
Imidlertid, hvis modelmembranen indeholder en "defekt" - en åbning, gennem hvilken lipidhaler kan glide ud - begynder nanopartikler at trænge ind i membranen. Når disse lipidfremspring forekommer, lipiderne og partiklerne klæber til hinanden, fordi de begge er hydrofobe, og partiklerne opsluges af membranen uden at beskadige den.
I rigtige cellemembraner, disse fremspring forekommer tilfældigt, især nær steder, hvor proteiner er indlejret i membranen. De forekommer også oftere i buede dele af membranen, fordi det er sværere for de hydrofile hoveder at dække et buet område fuldstændigt end et fladt, efterlader huller til lipidhalerne stikker ud.
"Det er et pakningsproblem, "Siger Alexander-Katz." Der er åbent rum, hvor haler kan komme ud, og der vil være vandkontakt. Det gør det bare 100 gange mere sandsynligt, at et af disse fremspring kommer ud i stærkt buede områder af membranen. "
Efterligner naturen
Dette fænomen ser ud til at efterligne en proces, der forekommer naturligt i celler - sammensmeltning af vesikler med cellemembranen. Vesikler er små kugler af membranlignende materiale, der transporterer last såsom neurotransmittere eller hormoner.
Ligheden mellem absorption af vesikler og indtræden af nanopartikler tyder på, at celler, hvor en masse vesikelfusion naturligt forekommer, kunne være gode mål for lægemiddellevering af guldnanopartikler. Forskerne planlægger yderligere at analysere, hvordan membranernes sammensætning og de proteiner, der er indlejret i dem, påvirker absorptionsprocessen i forskellige celletyper. "Vi vil virkelig forstå alle begrænsninger og bestemme, hvordan vi bedst kan designe nanopartikler til at målrette mod bestemte celletyper, eller områder af en celle, "Siger Van Lehn.
"Man kunne bruge resultaterne fra dette papir til at tænke over, hvordan man kan udnytte disse fund til forbedrede nanopartikeludleveringskøretøjer - f.eks. måske kunne nye overfladeligander til nanopartikler konstrueres til at have forbedret affinitet for både overfladegrupper og lipidhaler, "siger Catherine Murphy, en professor i kemi ved University of Illinois i Urbana-Champaign, der ikke var involveret i undersøgelsen.
Denne historie er genudgivet med tilladelse fra MIT News (web.mit.edu/newsoffice/), et populært websted, der dækker nyheder om MIT -forskning, innovation og undervisning.
 Varme artikler
Varme artikler
-
 Forståelse af, hvordan kræft spredes:Nanotech enkeltcelleovervågningsteknik kunne give indsigtRemy Elbez, en ph.d.-studerende i anvendt fysik, tager en prøve af en opløsning, der indeholder magnetiserede livmoderhalskræftceller. Han vil placere flere dråber af opløsningen i et særligt magnetfe
Forståelse af, hvordan kræft spredes:Nanotech enkeltcelleovervågningsteknik kunne give indsigtRemy Elbez, en ph.d.-studerende i anvendt fysik, tager en prøve af en opløsning, der indeholder magnetiserede livmoderhalskræftceller. Han vil placere flere dråber af opløsningen i et særligt magnetfe -
 Forskere skaber molekylær diodeDette er et skema for molekylær diode. Det symmetriske molekyle (øverst) giver mulighed for tovejsstrøm. Det asymmetriske molekyle (nederst) tillader kun strøm i én retning og fungerer som en enkelt-m
Forskere skaber molekylær diodeDette er et skema for molekylær diode. Det symmetriske molekyle (øverst) giver mulighed for tovejsstrøm. Det asymmetriske molekyle (nederst) tillader kun strøm i én retning og fungerer som en enkelt-m -
 Forvandler grafit til diamantSLAC-forskere har fundet en ny måde at omdanne grafit - en ren form for kulstof, der er mest kendt som blyanten i blyanter - til en diamantlignende film. Kredit:Fabricio Sousa/SLAC (Phys.org) – Et
Forvandler grafit til diamantSLAC-forskere har fundet en ny måde at omdanne grafit - en ren form for kulstof, der er mest kendt som blyanten i blyanter - til en diamantlignende film. Kredit:Fabricio Sousa/SLAC (Phys.org) – Et -
 Syntetisk hud kan hjælpe med sårhelingKunstig hud produceret ved hjælp af nanoskala teknologi. Kredit:Antonios Keirouz Ingeniører har udtænkt en stofforbinding, hvis tykkelse og elasticitet kan tilpasses til specifikke områder af krop
Syntetisk hud kan hjælpe med sårhelingKunstig hud produceret ved hjælp af nanoskala teknologi. Kredit:Antonios Keirouz Ingeniører har udtænkt en stofforbinding, hvis tykkelse og elasticitet kan tilpasses til specifikke områder af krop
- Hvordan man opbygger et vandur
- Nanopartikelforskning og fremtidens medicin
- Undersøgelsen finder stærke sammenhænge mellem tillid og brug af sociale medier
- Gør forurening tordenvejr mere alvorlig?
- Nyt hardcarbonanodemateriale til natriumionbatterier løser litiumproblemet
- Havorganismer kan makulere en plastpose i 1,75 millioner stykker, undersøgelse viser


