DNA-nanoteknologi placerer enzymkatalyse inden for en armslængde
Kredit:Jason Drees, Biodesign Instituttet ved ASU
Ved at bruge DNA-molekyler som et arkitektonisk stillads, Arizona State University videnskabsmænd, i samarbejde med kolleger ved University of Michigan, har udviklet en 3-D kunstig enzymkaskade, der efterligner en vigtig biokemisk vej, der kan vise sig vigtig for fremtidige biomedicinske og energianvendelser.
Resultaterne blev offentliggjort i tidsskriftet Natur nanoteknologi . Ledet af ASU Professor Hao Yan, forskerholdet omfattede ASU Biodesign Institute-forskere Jinglin Fu, Yuhe Yang, Minghui Liu, Professor Yan Liu og professor Neal Woodbury sammen med kolleger professor Nils Walter og postdoc Alexander Johnson-Buck ved University of Michigan.
Forskere inden for DNA-nanoteknologi, drage fordel af bindingsegenskaberne af de kemiske byggesten i DNA, vrid og selvsaml DNA til stadig mere fantasifulde 2- og 3-dimensionelle strukturer til medicinske, elektroniske og energiapplikationer.
I det seneste gennembrud, forskerholdet tog udfordringen op med at efterligne enzymer uden for cellens venlige rammer. Disse enzymer fremskynder kemiske reaktioner, bruges i vores kroppe til fordøjelse af mad til sukker og energi under menneskets stofskifte, for eksempel.
"Vi ser til naturen for at få inspiration til at bygge menneskeskabte molekylære systemer, der efterligner de sofistikerede maskiner i nanoskala, der er udviklet i levende biologiske systemer, og vi designer rationelt molekylære nanostilladser for at opnå biomimik på molekylært niveau, " sagde Yan, som besidder Milton Glick-stolen i ASU Department of Chemistry and Biochemistry og leder Center for Molecular Design and Biomimicry på Biodesign Institute.
Med enzymer, alle bevægelige dele skal være stramt kontrolleret og koordineret, ellers virker reaktionen ikke. De bevægelige dele, som omfatter molekyler såsom substrater og cofaktorer, alle passer ind i en kompleks enzymlomme ligesom en baseball i en handske. Når alle de kemiske dele har fundet deres plads i lommen, den energi, der styrer reaktionen, bliver gunstig, og få kemien til at ske hurtigt. Hvert enzym frigiver sit produkt, som en stafet afleveret i et stafetløb, til et andet enzym for at udføre det næste trin i en biokemisk vej i den menneskelige krop.
Til den nye undersøgelse, forskerne valgte et par universelle enzymer, glucose-6-phosphatdehydrogenase (G6pDH) og malatdehydrogenase (MDH), som er vigtige for biosyntese - fremstilling af aminosyrer, fedtstoffer og nukleinsyrer essentielle for alt liv. For eksempel, defekter fundet i banen forårsager anæmi hos mennesker. "Dehydrogenase-enzymer er særligt vigtige, da de leverer det meste af energien i en celle", sagde Walter. "Arbejde med disse enzymer kan føre til fremtidige anvendelser inden for grøn energiproduktion, såsom brændselsceller, der bruger biomaterialer til brændstof."
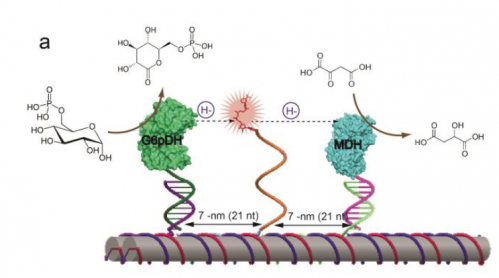
I stien, G6pDH bruger glukose-sukkersubstratet og en cofaktor kaldet NAD til at fjerne hydrogenatomer fra glukose og overføre til det næste enzym, MDH, at fortsætte med at lave æblesyre og generere NADH i processen, som bruges som en nøglekofaktor for biosyntese.
At genskabe dette enzympar i reagensglasset og få det til at virke uden for cellen er en stor udfordring for DNA-nanoteknologi.
Kredit:ASU Biodesign Institute / Natur nanoteknologi .
For at imødekomme udfordringen, de lavede først et DNA-stillads, der ligner flere papirhåndklæderuller limet sammen. Ved hjælp af et computerprogram, de var i stand til at tilpasse de kemiske byggesten i DNA-sekvensen, så stilladset ville samle sig selv. Næste, de to enzymer blev knyttet til enderne af DNA-rørene.
Midt på DNA-stilladset, de fikserede en enkelt DNA-streng, med NAD+ bundet til enden som en kugle og snor. Yan omtaler dette som en svingende arm, som er lang, fleksibel og fingernem nok til at gynge frem og tilbage mellem enzymerne.
Når først systemet blev lavet i et reagensglas ved at opvarme og afkøle DNA'et, hvilket fører til selvmontering, enzymdelene blev tilføjet. De bekræftede strukturen ved hjælp af et kraftigt mikroskop, kaldet en AFM, som kan se ned til nanoskalaen, 1, 000 gange mindre end bredden af et menneskehår.
Ligesom arkitekter, forskerne byggede først en fuldskalamodel, så de kunne teste og måle den rumlige geometri og strukturer, inkluderet i deres opsætning et lille fluorescerende farvestof fastgjort til den svingende arm. Hvis reaktionen finder sted, de kan måle et rødt beacon-signal, som farvestoffet afgiver - men i dette tilfælde, i modsætning til et trafiksignal, et rødt lys betyder, at reaktionen virker.
Næste, de prøvede enzymsystemet og fandt ud af, at det virkede på samme måde som en cellulær enzymkaskade. De målte også effekten ved at variere afstanden mellem den svingende arm og enzymerne. De fandt ud af, at der var et sødt sted, ved 7nm, hvor armvinklen var parallel med enzymparret.
Med en enkelt svingarm i reagensglassystemet fungerer ligesom de cellulære enzymer, de besluttede at tilføje våben, test af systemets grænser med op til 4 tilføjede arme. De var i stand til at vise, at efterhånden som hver arm blev tilføjet, G6pDH kunne følge med og lave endnu mere produkt, mens MDH havde maxet ud efter kun to svingende arme. "At placere enzymer langs et designet samlebånd, som Henry Ford gjorde for bildele, er særligt tilfredsstillende for en, der bor i nærheden af motorbyen Detroit, " sagde Walter.
Arbejdet åbner også en lys fremtid, hvor biokemiske veje kan replikeres uden for cellen for at udvikle biomedicinske applikationer såsom detektionsmetoder til diagnostiske platforme.
"Et endnu højere og mere værdifuldt mål er at konstruere højt programmerede kaskadende enzymbaner på DNA-nanostrukturplatforme med kontrol over input- og outputsekvenser. At nå dette mål ville ikke kun give forskere mulighed for at efterligne de elegante enzymkaskader, der findes i naturen og forsøge at forstå deres underliggende virkningsmekanismer, men ville lette konstruktionen af kunstige kaskader, der ikke findes i naturen, " sagde Yan.
Sidste artikelEn ny måde at lave ark af grafen på
Næste artikelAtomic force mikroskopsystemer tager et spids fra nanotråde
 Varme artikler
Varme artikler
-
 Opbygning af en trådløs mikromaskinePh.d.-kandidat Farrukh Mateen (ENG18) byggede en lillebitte resonator og tændte og slukkede den med en nanowatt strøm fra tre fods afstand - længden af en laboratoriebænk. Forskningen blev offentlig
Opbygning af en trådløs mikromaskinePh.d.-kandidat Farrukh Mateen (ENG18) byggede en lillebitte resonator og tændte og slukkede den med en nanowatt strøm fra tre fods afstand - længden af en laboratoriebænk. Forskningen blev offentlig -
 Et (nano-) vindue der vasker sig selv?Tel Aviv Universitets nanoserede skov af peptider kan bruges som grundlag for selvrensende vinduer og mere effektive batterier. Kredit:AFTAU En belægning på vinduer eller solpaneler, der afviser s
Et (nano-) vindue der vasker sig selv?Tel Aviv Universitets nanoserede skov af peptider kan bruges som grundlag for selvrensende vinduer og mere effektive batterier. Kredit:AFTAU En belægning på vinduer eller solpaneler, der afviser s -
 Discovery bringer termiske switches i nanoskala, der er nødvendige til næste generations computereForskere, der arbejder på et hærprojekt ved University of Michigan, udviklede termiske switches i nanoskala, der er nøglen til termisk styring af enheder i nanoskala, køling, data opbevaring, termisk
Discovery bringer termiske switches i nanoskala, der er nødvendige til næste generations computereForskere, der arbejder på et hærprojekt ved University of Michigan, udviklede termiske switches i nanoskala, der er nøglen til termisk styring af enheder i nanoskala, køling, data opbevaring, termisk -
 Rørformede solceller kunne væves ind i tøjIllustration af TiO2 nanorod-arrays på kulfibre fremstillet ved opløs og gro-metoden. Billedkredit:Guo, et al. ©2012 American Chemical Society (PhysOrg.com) -- Titania halvledende nanorods dyrket
Rørformede solceller kunne væves ind i tøjIllustration af TiO2 nanorod-arrays på kulfibre fremstillet ved opløs og gro-metoden. Billedkredit:Guo, et al. ©2012 American Chemical Society (PhysOrg.com) -- Titania halvledende nanorods dyrket
- Big Bang Theory får råb til Nobelprismeddelelsen
- Sådan konverteres centimeter til firkantede fødder
- Mød Madagaskars ældste dyreslægt, en hvirvlende bille med 206 millioner år gammel oprindelse
- Kommer rundt til stabil selvsamling
- Hvad betyder inokulering i mikrobiologi?
- Forskere støber neurale net for at simulere molekylær bevægelse


