Nanoskala lineal afslører organisering af cellemembranen
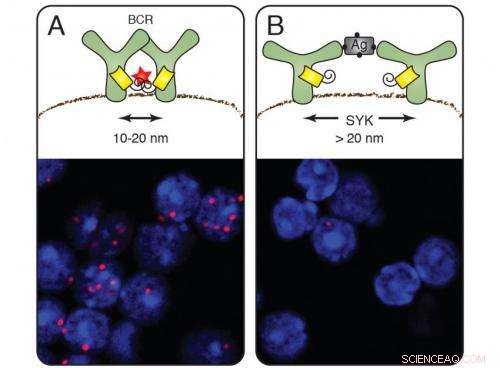
På hvilende celler (A) danner B -celle -antigenreceptorerne grupper, og nano -linealen udsender røde signaler (cellefarvning nedenfor). Efter aktivering af B-cellerne af et antigen forsvinder det røde signal (B). Kinasen Syk medierer åbningen af receptoren. Kredit:Michael Reth
Efter en ti års indsats, Prof. Dr. Michael Reth fra Institute of Biology III ved University of Freiburg og Max Planck Institute of Immunobiology and Epigenetics har udviklet en metode til at undersøge celleoverfladens organisation på en nanometer skala. Dette giver ham mulighed for at overvåge, hvordan antigenreceptoren, som B -celler i immunsystemet bruger til at genkende fremmede stoffer, ændringer efter aktivering. Denne undersøgelse viser, at receptorkomponenterne adskiller sig fra hinanden – snarere end at samle, som tidligere antaget. Reorganisering af receptorer på cellemembranen finder sted inden for et område på 10 til 40 nanometer. Under et optisk mikroskop, imidlertid, det er kun muligt at skelne mellem objekter, der ligger mindst 250 nanometer fra hinanden.
Ved at bruge antistoffragmenter, såkaldte Fabs, Reth, taler for cluster of excellence BIOSS Center for Biological Signaling Studies ved University of Freiburg, og hans team forbedrede opløsningen af det tidligere udviklede nærhedsligeringsassay (PLA) cirka 10 gange.
Denne teknologi tillader detektering af molekyler kun, når de er placeret tæt på hinanden. Ved hjælp af den mere præcise Fab-PLA metode, forskerne var i stand til for første gang nogensinde at undersøge på en ti-nanometer skala, hvordan receptorer fordeles på membranen, og hvordan de er reorganiseret. Fab-PLA-metoden er et vigtigt nyt instrument til BIOSS Nanoscale Explorer Progamme (BiNEP), et af forskningsfokuserne ved Cluster of Excellence BIOSS Center for Biological Signaling Studies ved University of Freiburg.
Når det påføres antigenreceptorerne, Fab-PLA-metoden afslørede røde fluorescerende prikker på cellemembranen af inaktive B-celler:bevis på, at antigenreceptorerne først vises på membranen i grupper, såkaldte receptorklynger. Så snart B -cellerne detekterede et antigen og blev aktiveret, imidlertid, prikkerne forsvandt - receptorerne var flyttet væk fra hinanden. Dette fund understøtter dissociationsmodellen for B -celleaktivering, der blev foreslået af Michael Reth og Jianying Yang i 2010.
Forskerne demonstrerede også, hvordan dissociationen opstår:De slettede i B-celler genet, der koder for signalmolekylet Syk, en kinase, der arbejder tæt sammen med antigenreceptoren. På B -celler uden Syk var receptorklyngerne stadig til stede, efter at de havde bundet antigenet. Syk er således den molekylære nøgle, der åbner receptorklyngen og initierer immunresponset. For at belyse de yderligere detaljer om aktiveringen af B -celler, forskerne introducerede Syk og antigenreceptorkomponenterne i frugtflueceller. De modificerede Syk og fastslog, at klyngen ikke er brudt op, før molekylet er bundet til den indre del af antigenreceptoren.
Forskerne offentliggjorde deres resultater i den nye open-access journal eLife . Undersøgelsen omfattede også en undersøgelse af organiseringen af yderligere receptorer på B-celler i nanoskala, herunder CD19- eller CD20 -molekylet. "Vi opdagede, at mange receptorer er organiseret på membranen i specifikke områder på nanoskalaniveau, " forklarer Kathrin Kläsener, Ph.d.-studerende og primær forfatter til undersøgelsen. Forskningen blev delvist finansieret af et Advanced Grant til nanoskala analyse af proteinøer på lymfocytter fra European Research Council (ERC), som Reth modtog i 2012.
 Varme artikler
Varme artikler
-
 Forskere udvikler syrefølsomme nanopartikler som ny behandling af bugspytkirtelkræftAksialt CT-billede med i.v. kontrast. Makrocystisk adenokarcinom i bugspytkirtlens hoved. Kredit:offentlig ejendom Forskerholdet ledet af prof. Yang Lihua fra Hefei National Laboratory for Physica
Forskere udvikler syrefølsomme nanopartikler som ny behandling af bugspytkirtelkræftAksialt CT-billede med i.v. kontrast. Makrocystisk adenokarcinom i bugspytkirtlens hoved. Kredit:offentlig ejendom Forskerholdet ledet af prof. Yang Lihua fra Hefei National Laboratory for Physica -
 Nanopore-teknologi tager et spring fra DNA-sekventering til at identificere proteinerKredit:University of California - San Diego I maj -udgaven af PLOS Computational Biology , forskere fra UC San Diego og University of Notre Dame rapporterer om en undersøgelse, der kunne åbne fe
Nanopore-teknologi tager et spring fra DNA-sekventering til at identificere proteinerKredit:University of California - San Diego I maj -udgaven af PLOS Computational Biology , forskere fra UC San Diego og University of Notre Dame rapporterer om en undersøgelse, der kunne åbne fe -
 Nye 2-D kvantematerialer til nanoelektronikDette diagram illustrerer konceptet bag MIT-teamets vision om en ny slags elektronisk enhed baseret på 2-D materialer. 2D-materialet er i midten af en lagdelt sandwich, med lag af et andet materiale
Nye 2-D kvantematerialer til nanoelektronikDette diagram illustrerer konceptet bag MIT-teamets vision om en ny slags elektronisk enhed baseret på 2-D materialer. 2D-materialet er i midten af en lagdelt sandwich, med lag af et andet materiale -
 Brug af solid-state materialer med guld nanoantenner for mere holdbare solcellerEn solid-state solcelle sammensat af titaniumdioxid, nikkeloxid, og guld nanopartikler. Guldnanopartikler høster lys og giver et synligt lysrespons til cellen. Kredit:Tomoya OSHIKIRI, Hokkaido Univers
Brug af solid-state materialer med guld nanoantenner for mere holdbare solcellerEn solid-state solcelle sammensat af titaniumdioxid, nikkeloxid, og guld nanopartikler. Guldnanopartikler høster lys og giver et synligt lysrespons til cellen. Kredit:Tomoya OSHIKIRI, Hokkaido Univers
- Massivt boliviansk jordskælv afslører bjerge 660 kilometer under vores fødder
- Nanoskala billeddannelse af dopant nanostrukturer i silicium-baserede enheder
- Matematikere genopliver den forladte tilgang til Riemann-hypotesen
- Globale fossile brændstoffers udledninger af kulbrinter er undervurderet
- Indeholder RNA en genetisk kode?
- Instant messaging i proteiner opdaget


