Selvmontering af lagdelte membraner

Fig. 1. Skematisk illustration af en sæk indesluttet i en tre-zone membran, dannet som en dråbe HA i opløsning falder ned i en PA-opløsning. Det inderste lag (1) er en gel af HA-molekyler. Den er omgivet af et lag af nanofibre, der ligger tangentielt på sækkens overflade (2), hvoraf nanofibre kommer vinkelret ud (3).
Teknikker til at skabe komplekse nanostrukturerede materialer gennem selvsamling af molekyler er blevet stadig mere sofistikerede. Men at føre disse teknikker til det biologiske område har været problematisk. For nylig, forskere fra Northwestern University brugte selvsamling under kontrollerede forhold til at skabe en membran bestående af lag med tydeligt forskellige strukturer. Nu, arbejder ved det amerikanske energiministeriums Advanced Photon Source (APS), holdet brugte small-angle x-ray scattering (SAXS) til bedre at bestemme disse strukturer og studere, hvordan de dannes. Denne nye information baner vejen for design og syntese af hierarkiske strukturer med biomedicinske applikationer.
Peptidamfifiler (PA) er kæder af aminosyrer, der er spidset med andre molekyler, så den ene ende er hydrofil (blandes godt med vand) og den anden hydrofob (ikke glad for vand). I vandig opløsning, PA'er er lange, tynde nanofibre, da aminosyrekæderne binder til tilstødende kæder for at danne β–sheets. Forskerne fra Northwestern University havde tidligere fundet ud af, at når en vandig opløsning indeholdende positivt ladede PA'er blev sat i kontakt med en vandig opløsning af negativt ladet hyaluronsyre (HA - et stort biologisk molekyle, der forekommer i bindevæv og andet væv), en tæt, fibrøst lag dannet inden for millisekunder, skabe en barriere, der forhindrede de to løsninger i at blande sig.
Mere præcist, forskerne fandt ud af, at det fibrøse lag forhindrer aggregerede PA'er i at migrere til HA-siden, men tillader HA-molekyler langsomt at insinuere sig selv gennem barrieren til PA-siden, på en tidsskala på minutter eller længere.
Resultatet var en tre-zone membranstruktur:et gel-lignende lag på HA-siden, en fibermåtte bestående af PA nanofibre, der ligger i planet for grænsefladen mellem opløsningerne, og en belægning af fibre rettet vinkelret væk fra grænsefladen og dannet af elektrostatisk bundne komplekser af PA og HA (fig. 1).
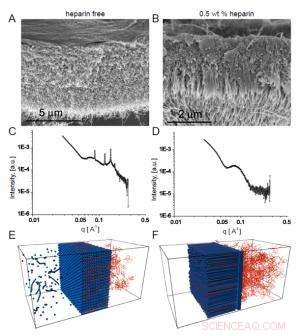
Fig. 2. Scanningselektronmikrofotografier viser den homogene membran, der dannes i fravær af heparin (A), mens der i nærvær af heparin dannes en fibrøs struktur på tværs af membranen (B).
Holdets interesse for disse membraner var afhængig af mulige biomedicinske anvendelser, hvor peptidsekvensen, der danner nanofibrene, ville have en valgt biologisk aktivitet. I et eksempel de inkorporerede en heparinbindende sekvens for at fremme angiogenese (dannelsen af nye blodkar), så membranen kan hjælpe med vævsreparation. For at strukturen med tre zoner kan dannes, forskerne fandt ud af, at HA-opløsningen skulle indeholde heparin i et vist koncentrationsområde. Scanningselektronmikroskopi viste tydeligt lineær struktur, der krydsede membranen, der blev dannet, når heparin var til stede ved 0,5 vægt-% (fig. 2a). i modsætning til det mere homogene udseende af membranen skabt i fravær af heparin (fig. 2b).
Forskerne henvendte sig til SAXS ved DuPont-Northwestern-Dow Collaborative Access Team beamline 5-ID-D ved Argonne APS, en Office of Science brugerfacilitet. Disse undersøgelser giver indsigt i den præcise struktur af de tre-zone membraner og en bedre forståelse af dynamikken i deres dannelse.
De heparinfrie membraner producerede veldefinerede Bragg-toppe, mens tre-zone membranerne ikke gjorde det. I øvrigt, membraner, der opstod i nærvær af mindre heparinkoncentrationer, viste større Bragg-toppe end dem, der blev produceret, når heparinkoncentrationen var højere, hvilket indikerer en konkurrence mellem to strukturer, hvis udfald afhang af heparinniveauer.
En tidsserie af SAXS-målinger på et heparinfrit eksperiment viste, at Bragg-toppene begyndte at dannes et par minutter efter, at de to opløsninger var bragt i kontakt, og nåede fuld styrke efter cirka 45 minutter.
Fortolkning af SAXS-resultaterne i lyset af deres tidligere eksperimenter og de kendte egenskaber af PA'er og HA, forskerne forklarer forskellene mellem de to typer membraner som følge af forskellige former for aggregering. I fravær af heparin, PA og HA samles i nanosfæriske aggregater, der pakker sammen i et kubisk arrangement, over en periode på nogle ti minutter, at danne en membran, der genererer veldefinerede Bragg-toppe.
Når heparin er til stede, derimod det binder stærkt til PA og ændrer dets interaktion med AH-molekyler. I dette tilfælde, en barriere af nanofibre, der ligger parallelt med opløsningsgrænsefladen, dannes øjeblikkeligt, fungerer derefter som en diffusionsbarriere, hvorigennem HA langsomt passerer. Som det kommer frem på den anden side, det binder til PA for at danne nanofibre, der vokser vinkelret på grænsefladen. Dette ordnede nanofiber-array producerer ingen Bragg-toppe.
Den øgede forståelse og kontrol af disse processer afledt af denne forskning kunne gøre det muligt at bygge bioaktive membraner med en række forskellige strukturer og formål.
 Varme artikler
Varme artikler
-
 Spontan dannelse af hule strukturer i nanoskala kan øge batteriopbevaringSmå batterier blev brugt til at studere den spontane dannelse af hule strukturer i nanoskala i Matthew McDowells laboratorium ved Georgia Tech. Kredit:Matthew McDowell, Georgia Tech En uventet ege
Spontan dannelse af hule strukturer i nanoskala kan øge batteriopbevaringSmå batterier blev brugt til at studere den spontane dannelse af hule strukturer i nanoskala i Matthew McDowells laboratorium ved Georgia Tech. Kredit:Matthew McDowell, Georgia Tech En uventet ege -
 Kobber skinner som fleksibel lederSensorer lavet med kobber er billige, lys, fleksibel og meget ledende. Bøj dem, stræk dem, vride dem, fold dem:moderne materialer, der er lette, fleksibel og meget ledende har ekstraordinært tekno
Kobber skinner som fleksibel lederSensorer lavet med kobber er billige, lys, fleksibel og meget ledende. Bøj dem, stræk dem, vride dem, fold dem:moderne materialer, der er lette, fleksibel og meget ledende har ekstraordinært tekno -
 Nanomateriale forbedrer væsentligt potentiel COVID-19-terapiRent niclosamid (venstre) skygger en opløsning, og lægemidlets krystallinske struktur forhindrer absorption. OHPP-udviklet niclosamid (højre), skabt af Purdues Yuan Yao, er over 5, 000 gange mere oplø
Nanomateriale forbedrer væsentligt potentiel COVID-19-terapiRent niclosamid (venstre) skygger en opløsning, og lægemidlets krystallinske struktur forhindrer absorption. OHPP-udviklet niclosamid (højre), skabt af Purdues Yuan Yao, er over 5, 000 gange mere oplø -
 Ny metode til at måle temperaturen på objekter i nanoskala opdagetEksperimentel skematisk. Silica-kugler svæver i en optisk pincet med to stråler inde i et vakuumkammer. Lys med bølgelængde 1, 064 nm er koblet til linser fra single-mode optiske fibre, skabe en optis
Ny metode til at måle temperaturen på objekter i nanoskala opdagetEksperimentel skematisk. Silica-kugler svæver i en optisk pincet med to stråler inde i et vakuumkammer. Lys med bølgelængde 1, 064 nm er koblet til linser fra single-mode optiske fibre, skabe en optis
- VERITAS:udforske de dybe sandheder om Venus
- Tyskland rejser 6,5 mia. euro fra salg af 5G-frekvenser
- Vi er nødt til at tale om COVID-19 dødsfald
- Hvor til Rock Hunt Gems i Idaho
- Formodet ung stjerne viser sig at være en galaktisk ældre borger
- New Zealands leder siger ingen endelig beslutning om at bruge Huawei


