Nanopartikler infiltrerer, dræbe kræftceller indefra
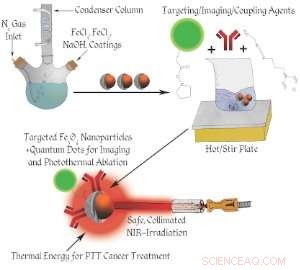
Skematisk af nanopartikelkonstruktion.
Konventionel behandling søger at udrydde kræftceller ved hjælp af lægemidler og terapi leveret uden for cellen, som også kan påvirke (og potentielt skade) nærliggende normale celler.
I modsætning til konventionel kræftbehandling, et team fra University of Cincinnati har udviklet flere nye designs til jernoxidbaserede nanopartikler, der detekterer, diagnosticere og ødelægge kræftceller ved hjælp af fototermisk terapi (PTT). PTT bruger nanopartiklerne til kun at fokusere lysinduceret varmeenergi i tumoren, skader ingen tilstødende normale celler.
Resultaterne af UC-arbejdet vil blive præsenteret på Materials Research Society Conference i Boston 30. november-dec. 5 af Andrew Dunn, ph.d.-studerende i materialevidenskab på UC's Ingeniørhøjskole. Donglu Shi arbejder sammen med Dunn i denne undersøgelse, professor i materialevidenskab på UC's College of Engineering and Applied Science; David Mast, lektor i fysik ved UC's McMicken College of Arts and Sciences; og Giovanni Pauletti, lektor ved James L. Winkle College of Pharmacy.
UC-studiet brugte de levende celler fra mus til med succes at teste effektiviteten af deres tosidede nanopartikeldesign (den ene side til cellemålretning og den anden til behandlingslevering) i kombination med PTT. Imidlertid, US Food and Drug Administration har nu godkendt brugen af jernoxidnanopartikler hos mennesker. Det betyder, at den fototermiske effekt af jernoxidnanopartikler kan vise, i det næste årti, et stærkt løfte i human cancerterapi, sandsynligvis med lokaliserede tumorer.
Hvordan nanopartiklerne virker med fototermisk terapi
Med denne teknologi, en laserstråle med lav effekt er rettet mod tumoren, hvor en lille mængde magnetiske jernoxid-nanopartikler er til stede, enten ved at injicere partiklerne direkte i tumoren eller ved at sprøjte dem ind i blodbanen, hvorved partiklerne finder og binder sig til de unormale kræftceller via cellespecifik målretning.
Der genereres derefter tilstrækkelig varme lokalt af laserlyset, hæve tumortemperaturen hurtigt til over 43 grader Celsius, og derved brænde de unormale kræftceller. Denne særlige PTT-behandling involverer ingen medicin, men genererer kun lokal varme i tumoren, giver derfor meget færre bivirkninger end de traditionelle kemo- eller strålebehandlinger.
"Denne behandling er meget mere ideel, fordi den går direkte til kræftcellen, " siger Shi. "Nanomaterialerne trænger kun ind i de unormale celler, belyse disse celler og derefter gøre, hvad det er, du har designet dem til at gøre. I dette tilfælde, det er at varme op varmt nok til at brænde og dræbe kræftcellerne, men ikke skade de omgivende normale celler."
Shi tilføjede, at læger ofte er frustrerede over de nuværende konventionelle metoder til tidlig billeddannelse af kræftceller gennem medicinsk resonansbilleddannelse eller computertomografi-scanninger, fordi tumorerne normalt er i fase tre eller fire, før de kan opdages. Han udtalte, "Med nanomaterialeteknologi, vi kan opdage tumoren tidligt og dræbe den på samme tid."
Cellemålretning
Hver tumor har et tilsvarende protein, der er kræftspecifikt, kaldet en tumorspecifik ligand eller en antistofantigenreaktion, der kun har udtryk for den specifikke kræft, såsom bryst- eller prostatacancer.
Forskere identificerer denne bestemte biomarkør, der er specifik for en bestemt tumor, konjugerer derefter denne biomarkør på overfladen af nanobæreren, der kun har udtrykket for den specifikke slags cancercelle.
Det retter sig kun mod den unormale kræftcelle, ikke normal, sunde celler, og fordi den er så lille, kan den bryde membranen og komme ind i den konjugerede cancercelle og frigive PTT.
Nanoteknologiske bærere går ind i kroppen gennem en vene i blodbanen, søge de unormale kræftceller, finde biomarkøren eller kræftcellerne og binde sig til disse celler og låse deres fluorescerende partikler op, så de kan detekteres af et foton-laserlys.
Laserlyset opvarmer nanopartiklerne til mindst 43 grader Celsius for at dræbe kræftcellerne, i sidste ende efterlader alle de andre celler i kroppen uskadt.
Potentiel gør-det-selv-kræftbehandling
Proceduren kan i sidste ende udføres af patienten efter træning for at dirigere en lille laserlysanordning til det berørte område i et bestemt tidsrum to til tre gange om dagen. Denne metode kan i sidste ende forbedre succesraten, samt reducere omkostningerne for patienten. Dette giver "peg og skyd" en helt ny betydning.
Fremtidig forskning i nanopartikel PTT vil se på toksicitet, problemer med biologisk nedbrydelighed og kompatibilitet. Shi sagde, at holdet i øjeblikket leder efter andre forskellige biologisk nedbrydelige materialer til brug for bærerne, såsom planteklorofyler som dem i kål, der er både spiselige og fototermiske. Dette materiale er biokompatibelt og bionedbrydeligt og kan potentielt forblive i tumorcellerne, indtil dets arbejde er afsluttet, derefter opløses og ledes ud gennem fordøjelsessystemet.
 Varme artikler
Varme artikler
-
 Innovation er et skridt i retning af digitale grafentransistorerForskere gør fremskridt med at skabe digitale transistorer ved hjælp af et materiale kaldet grafen, muligvis omgå en forhindring, der menes at dramatisk begrænse materialets brug i computere og forbru
Innovation er et skridt i retning af digitale grafentransistorerForskere gør fremskridt med at skabe digitale transistorer ved hjælp af et materiale kaldet grafen, muligvis omgå en forhindring, der menes at dramatisk begrænse materialets brug i computere og forbru -
 Røntgenpulser afdækker gratis nanopartikler for første gang i 3DVidvinkel-røntgendiffraktionsbillede af en afskåret twinnet tetraeder-nanopartikel. Kredit:Hannes Hartmann/University of Rostock For første gang, et tysk-amerikansk forskerhold har bestemt den tre
Røntgenpulser afdækker gratis nanopartikler for første gang i 3DVidvinkel-røntgendiffraktionsbillede af en afskåret twinnet tetraeder-nanopartikel. Kredit:Hannes Hartmann/University of Rostock For første gang, et tysk-amerikansk forskerhold har bestemt den tre -
 Mindre er bedre i den viskøse zoneDisse er nanorør. Kredit:Jei Liu At være den rigtige størrelse og eksistere i limbo mellem en fast og en flydende tilstand ser ud til at være hemmelighederne bag at forbedre effektiviteten af ke
Mindre er bedre i den viskøse zoneDisse er nanorør. Kredit:Jei Liu At være den rigtige størrelse og eksistere i limbo mellem en fast og en flydende tilstand ser ud til at være hemmelighederne bag at forbedre effektiviteten af ke -
 Styrer fuldt integrerede nanodiamanterNanofotonisk integration til samtidig styring af et stort antal kvantemekaniske spins i nanodiamanter. Kredit:P. Schrinner/AG Schuck Ved hjælp af moderne nanoteknologi, det er i dag muligt at frem
Styrer fuldt integrerede nanodiamanterNanofotonisk integration til samtidig styring af et stort antal kvantemekaniske spins i nanodiamanter. Kredit:P. Schrinner/AG Schuck Ved hjælp af moderne nanoteknologi, det er i dag muligt at frem
- Portugisiske naturbrande omkranser Algarve ferieby
- Videnskabens advarsler, USA's tilbagetog gør FN's klimaforhandlinger mere presserende
- Prototype kamerasæt til integration i et nyt gamma-stråleteleskop
- Hvorfor forbrugere skjuler og ikke kan lide mærker på Facebook
- Kinas tunge løfteraketaffyring mislykkes:statslige medier
- 3 jordskælv ryster Alaskas største by, men ingen skadesrapporter


