Et biologisk flugtrum:Fysikere får et glimt udefra af proteinaggregater, der forårsager diabetes
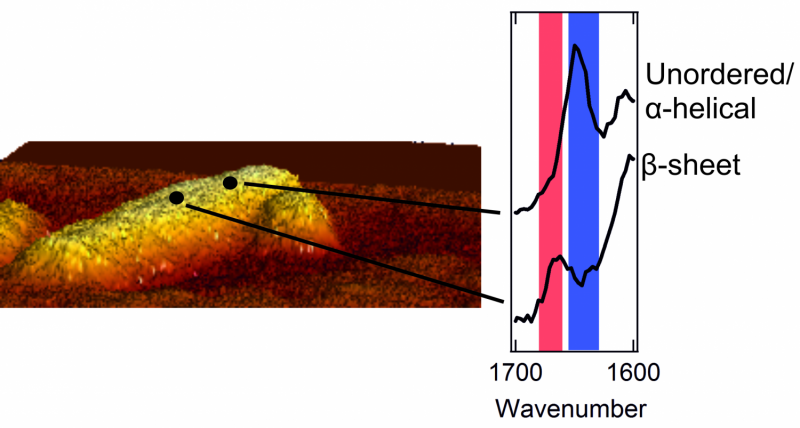
Til venstre:et atomkraftmikroskopbillede af en fibril med en diameter på nogle få nanometer. Til højre:to spektre, der viser den ydre struktur. En top i det røde område er karakteristisk for et plaster med en pænt ordnet betaarkstruktur. En top i det blå område er typisk for et område med kaotisk, rodet struktur.
Forskere fra FOM Instituttet AMOLF har, for første gang nogensinde, formået at lave et billede af den ydre struktur af et proteinaggregat, der forårsager sygdomme som Alzheimer og type-2 diabetes. De opdagede, at den udvendige overflade af disse aggregater er struktureret på en meget rodet måde - meget i modsætning til deres pænt arrangerede interiør. Forskerne håber, at deres arbejde vil give mere indsigt i, hvordan aggregaterne beskadiger nærliggende celler. Forskningsresultaterne blev offentliggjort online i tidsskriftet Lille den 7. maj, 2015.
Proteinaggregaterne undersøgt af forskerne består af lange, foldede proteiner. Forskere har været bekendt med den indre struktur af disse aggregater (formelt kendt som amyloidfibriller) i ret lang tid. Imidlertid, med konventionelle mikroskoper forblev det altid umuligt at se proteinstrukturerne på den ydre overflade af aggregaterne. Set i bakspejlet, det var, som om forskerne var spærret inde i et hus. De kunne grundigt studere husets indre, men så længe de ikke havde nøglen, de var ude af stand til at træde ud og se på dens facade på ydersiden. Gennembruddet kom, da forskerne udtænkte den 'nøgle' ved at kombinere to forskellige teknikker:mikroskopi og spektroskopi. Dette gav dem mulighed for endelig at studere det ydre 'murværk'.
Rodet
Når de først kunne få et glimt af det ydre af proteinaggregaterne, forskerne ventede sig en overraskelse. Det indre af aggregaterne er strengt organiseret. Proteinerne er pænt arrangeret i en såkaldt beta-arkstruktur, som danner en snoet, plisseret ark. Imidlertid, de fandt ud af, at det ydre af tilslaget har en meget mere rodet og kaotisk struktur. Det er, de ydre proteiner danner en uorganiseret, uregelmæssigt mønster. Her og der, der er patches, der danner en beta-arkstruktur, men andre steder findes denne regelmæssighed ingensteds. Forskerne fandt endda strukturelle forskelle fra den ene nanometer til den næste, på en og samme fibril.
Forskerne bemærkede også, at hver fibrils ydre struktur er meget forskellig fra den næste. En fibril kan indeholde mange plastre med en beta-arkstruktur, mens en anden mangler disse almindelige plastre næsten fuldstændigt. I øvrigt, de aminosyrer, der kan findes på ydersiden, er også forskellige for hver fibril.
Det rodede ydre er i direkte kontakt med membranerne i naboceller. På denne måde dens struktur spiller en afgørende rolle i at beskadige disse celler. Denne type celleskade er almindeligt forekommende hos patienter med type-2 diabetes eller Alzheimers sygdom.
'Nøglen', der åbnede dørene
AMOLF-forskerne samarbejdede med deres kolleger ved Utrecht University, Max Planck Institute for Polymer Research i Mainz, og Leibniz Institute for Photonic Technology i Jena for at udvikle en ny måde at se aggregaternes ydre proteinstruktur på. Nøglen viste sig at være en kombination af spektroskopi og atomkraftmikroskopi.
Et atomkraftmikroskop består af en skarp spids (sonde), der bevæger sig over et objekts overflade. Dette gør det muligt for mikroskopet at udforske en amyloid fibril på atomær skala og lave et reliefkort. I mellemtiden spektrometeret måler det såkaldte Raman-spektrum for hver pixel på kortet. Disse spektre giver information om, hvordan proteinerne foldes, og tilstedeværelsen af specifikke aminosyrer på aggregaternes overflade. Signalerne målt af spektrometeret er normalt svage, men et metallisk lag på spidsen af mikroskopet forstærker dem meget.
Billeder af amyloidfibrillernes ydre var blevet lavet før, men holdet afbildede nu også den måde, proteinerne blev foldet på. Førsteforfatter Corianne van den Akker:"Ved at kombinere mikroskopi og spektroskopi, vi formåede at knytte hver del af strukturen til en placering på amyloidens ydre. På denne måde vi kunne lave et billede med opløsning i nanoskala, samt bestemme strukturen på hvert sted. Det er den unikke bedrift ved den teknik, vi brugte."
Det næste skridt
Med den nyvundne viden, det vil også være muligt at måle strukturen af amyloider, der er dannet på ydersiden af levende celler. Teknikken kan også bruges til at teste medicin, der har til formål at forebygge eller opløse proteinaggregater.
 Varme artikler
Varme artikler
-
 Æggebaseret elektronik tilbyder overraskende god elektrisk ydeevne(Venstre) Kyllingeæg bestående af albumin og blomme. (Til højre) De gennemsigtige og fleksible hukommelsesceller fremstillet af det hydrogenperoxid-modificerede ægalbumin. Kredit:Zhou et al. ©2017 IOP
Æggebaseret elektronik tilbyder overraskende god elektrisk ydeevne(Venstre) Kyllingeæg bestående af albumin og blomme. (Til højre) De gennemsigtige og fleksible hukommelsesceller fremstillet af det hydrogenperoxid-modificerede ægalbumin. Kredit:Zhou et al. ©2017 IOP -
 Forbedret, men alligevel overkommeligt materiale til superkondensatorer:Masseproduktion af 3D mesopo…3D mesoporøs grafen. Kredit:UNIST Koreanske forskere fra Ulsan National Institute of Science and Technology (UNIST) udviklede en ny metode til massivt at syntetisere forbedrede, men alligevel over
Forbedret, men alligevel overkommeligt materiale til superkondensatorer:Masseproduktion af 3D mesopo…3D mesoporøs grafen. Kredit:UNIST Koreanske forskere fra Ulsan National Institute of Science and Technology (UNIST) udviklede en ny metode til massivt at syntetisere forbedrede, men alligevel over -
 Todimensionelle materialer så revolutionerende som grafenKredit:University of Manchester Ekstremt tynde stakke af todimensionelle materialer, som kunne levere applikationer finjusteret til industriens krav, er sat til at revolutionere verden på samme må
Todimensionelle materialer så revolutionerende som grafenKredit:University of Manchester Ekstremt tynde stakke af todimensionelle materialer, som kunne levere applikationer finjusteret til industriens krav, er sat til at revolutionere verden på samme må -
 Fyrre-seks transistorer konstrueret på seks CNT'er er den mest komplicerede enhed af sin art til da…SEM-billede af en otte-transistor (8-T) enhed, der var fremstillet på to CNTer (markeret med to hvide stiplede linjer). Skalaen er 100 µm. Kredit:Pei, et al. © 2014 American Chemical Society (Phys
Fyrre-seks transistorer konstrueret på seks CNT'er er den mest komplicerede enhed af sin art til da…SEM-billede af en otte-transistor (8-T) enhed, der var fremstillet på to CNTer (markeret med to hvide stiplede linjer). Skalaen er 100 µm. Kredit:Pei, et al. © 2014 American Chemical Society (Phys


