Forskere bruger nanoskopiske porer til at undersøge proteinstruktur
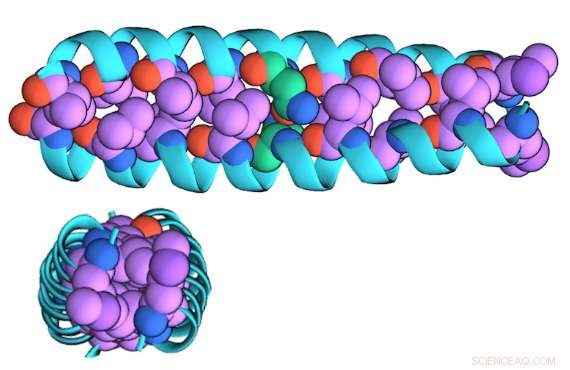
En illustration af den "zippede" dimerform af GCN4-p1 set fra siden (øverst) og over (nederst)
Forskere fra University of Pennsylvania har gjort fremskridt mod en ny metode til gensekventering af en streng af DNA's baser aflæses, mens de føres gennem et nanoskopisk hul.
I en ny undersøgelse, de har vist, at denne teknik også kan anvendes på proteiner som en måde at lære mere om deres struktur.
Eksisterende metoder til denne type analyser er arbejdskrævende, typisk medfører indsamling af store mængder af proteinet. De kræver også ofte modificering af proteinet, begrænser disse metoders anvendelighed til at forstå proteinets adfærd i dets naturlige tilstand.
Penn-forskernes translokationsteknik gør det muligt at studere individuelle proteiner uden at ændre dem. Prøver taget fra et enkelt individ kunne analyseres på denne måde, åbning af ansøgninger til sygdomsdiagnostik og forskning.
Undersøgelsen blev ledet af Marija Drndić, en professor i School of Arts &Sciences' Institut for Fysik &Astronomi; David Niedzwiecki, en postdoc-forsker i hendes laboratorium; og Jeffery G. Saven, en professor i Penn Arts &Sciences' Institut for Kemi.
Det blev offentliggjort i tidsskriftet ACS Nano .
Penn-teamets teknik stammer fra Drndićs arbejde med nanopore-gensekventering, som har til formål at skelne baserne i en DNA -streng med de forskellige procentdele af blænde, de hver blokerer, når de passerer gennem en nanoskopisk pore. Forskellige silhuetter tillader forskellige mængder af en ionisk væske at passere igennem. Ændringen i ionstrømning måles ved elektronik, der omgiver poren; toppe og dale i dette signal kan korreleres til hver base.
Mens forskere arbejder på at øge nøjagtigheden af disse aflæsninger til nyttige niveauer, Drndić og hendes kolleger har eksperimenteret med at anvende teknikken på andre biologiske molekyler og strukturer i nanoskala.
Samarbejde med Savens gruppe, de satte sig for at teste deres porer på endnu vanskeligere biologiske molekyler.
"Der er mange proteiner, der er meget mindre og sværere at manipulere end en DNA-streng, som vi gerne vil studere, " sagde Saven. "Vi er interesserede i at lære om strukturen af et givet protein, såsom om det eksisterer som en monomer, eller kombineret med en anden kopi til en dimer, eller et aggregat af flere kopier kendt som en oligomer."
Detektion er også ofte en begrænsning.
"Der er ingen måder at amplificere peptider og proteiner, som der er for DNA, " sagde Drndić. "Hvis du vil studere proteiner fra en bestemt kilde, du sidder fast med meget små prøver. Med denne metode, imidlertid, du kan bare indsamle den mængde data, du har brug for, og antallet af proteiner, du ønsker at passere gennem poren og derefter studere dem én ad gangen, da de naturligt findes i kroppen."
Ved at bruge Drndić-gruppens siliciumnitrid-nanoporer, som kan bores til tilpassede diametre, forskerholdet satte sig for at teste deres teknik på GCN4-p1, et protein udvalgt, fordi det indeholder et fælles strukturelt motiv, der findes i transkriptionsfaktorer og intracellulære receptorer.
"Dimer-versionen er 'zippet' sammen, " sagde Niedzwiecki, "Det er en 'spolet spole' af sammenflettede spiraler, der er nogenlunde cylindrisk. Monomerversionen er løsnet og er sandsynligvis ikke spiralformet; det er sandsynligvis mere som en streng."
Forskerne lagde forskellige forhold mellem lynlåste og udpakkede versioner af proteinet i en ionisk væske og førte dem gennem porerne. Selvom vi ikke var i stand til at fortælle forskellen mellem individuelle proteiner, forskerne kunne udføre denne analyse af molekylets populationer.
"Dimer- og monomerformen af proteinet blokerer et andet antal ioner, så vi ser et andet fald i strøm, når de går gennem poren, " sagde Niedzwiecki. "Men vi får en række værdier for begge, da ikke enhver molekylær translokationsbegivenhed er den samme."
Bestemmelse af, om en specifik prøve af disse typer af proteiner aggregeres eller ej, kunne bruges til bedre at forstå sygdommens udvikling.
"Mange forskere, " sagde Saven, "har observeret disse lange virvar af aggregerede peptider og proteiner i sygdomme som Alzheimers og Parkinsons, men der er et stigende antal beviser, der tyder på, at disse sammenfiltringer opstår efter kendsgerningen, at det, der virkelig forårsager problemet, er mindre proteinsamlinger. At finde ud af, hvad disse samlinger er, og hvor store de er, er i øjeblikket virkelig svært at gøre, så dette kan være en måde at løse det problem på."
 Varme artikler
Varme artikler
-
 Forskere leder efter nanostrukturer, der tillader kompatibilitet mellem metal og menneskelige knogle…Et af målene for Cimav-specialister er at udvikle biomedicinske implantater, der er nødvendige i Mexico, da dem, der findes på hjemmemarkedet, normalt fremstilles i udlandet. Forskellige videnskabeli
Forskere leder efter nanostrukturer, der tillader kompatibilitet mellem metal og menneskelige knogle…Et af målene for Cimav-specialister er at udvikle biomedicinske implantater, der er nødvendige i Mexico, da dem, der findes på hjemmemarkedet, normalt fremstilles i udlandet. Forskellige videnskabeli -
 Nanoteknologi leverer hepatitis B-vaccineKredit:CC0 Public Domain Brasilianske og europæiske forskere har demonstreret præcis, hvordan en nanoteknologi-baseret forbindelse leverer en oral vaccine mod hepatitis B til immunsystemet. Når pa
Nanoteknologi leverer hepatitis B-vaccineKredit:CC0 Public Domain Brasilianske og europæiske forskere har demonstreret præcis, hvordan en nanoteknologi-baseret forbindelse leverer en oral vaccine mod hepatitis B til immunsystemet. Når pa -
 2D nanomateriale MXene:Det perfekte smøremiddel til rovereAtomlagene kan bevæge sig i forhold til hinanden, reducere friktion. Kredit:Vienna University of Technology Du kan smøre en cykelkæde med olie, men hvad gør man med en Mars-rover eller et rødgløde
2D nanomateriale MXene:Det perfekte smøremiddel til rovereAtomlagene kan bevæge sig i forhold til hinanden, reducere friktion. Kredit:Vienna University of Technology Du kan smøre en cykelkæde med olie, men hvad gør man med en Mars-rover eller et rødgløde -
 Strækning af enkeltmolekyler muliggør præcisionsstudier af interagerende elektronerEt scanningselektronmikrograf af en guldbro suspenderet 40 nanometer over et siliciumsubstrat. I forsøget, broen er afskåret i midten, et enkelt molekyle er suspenderet hen over hullet, og substratet
Strækning af enkeltmolekyler muliggør præcisionsstudier af interagerende elektronerEt scanningselektronmikrograf af en guldbro suspenderet 40 nanometer over et siliciumsubstrat. I forsøget, broen er afskåret i midten, et enkelt molekyle er suspenderet hen over hullet, og substratet
- Katastrofal galaktisk kollision kan få solsystemet til at flyve ud i rummet
- Ridningsplatforme kan tage ledernes plads i koncertøkonomien
- Flydende saltvand over denne superhydrofobe overflade kan generere elektricitet
- En matematisk model til at beskrive spaghetti-nudler, når de er kogt
- NASAs ARIA kortlægger Californiens naturbrande fra rummet
- Forskere laver syntetiske polymerer inde i levende celler


