Nye nanoskopiske værktøjer til undersøgelse af ligandbinding af receptorer og kvantificering af to ligandbindingssteder
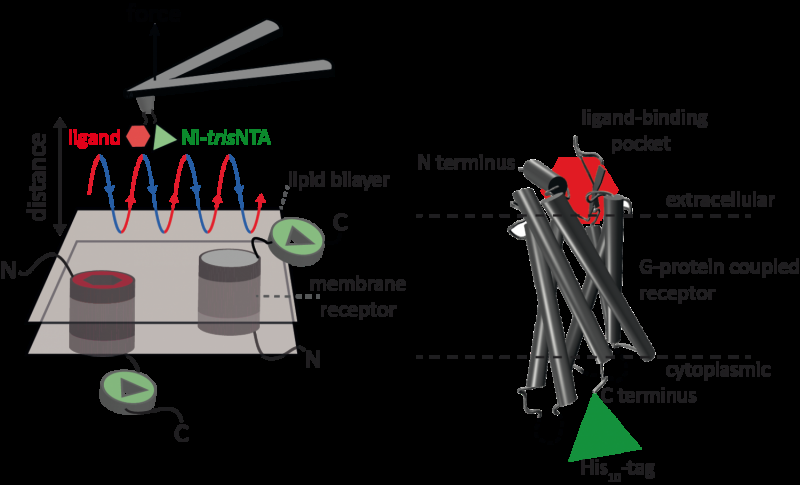
En ny højopløsningsmetode udviklet af et internationalt team af forskere, herunder Robert Tampé og Ralph Wieneke fra Goethe University Frankfurt, muliggør nu første gang præcis identifikation og kvantificering af interaktioner mellem en receptor med to ligander samtidigt. Kredit:GU
Signalprocesser i organismer styres af specifikke ekstracellulære og intracellulære interaktioner og involverer hundredvis af forskellige funktionelt meget alsidige receptorer placeret i cellemembraner. For forskere, der ønsker at forstå signalprocesser, bliver situationen mere kompleks af, at receptorerne ikke blot er ujævnt fordelt og ofte er i stand til at binde mere end en ligand, men også ved at den samme type receptor kan binde en ligand stærkt, svagt eller ikke alle. Nye metoder, der tillader præcise kvantificeringer af sådanne komplekse interaktioner, er påtrængende påkrævet.
En ny højopløsningsmetode udviklet af et internationalt team af forskere, herunder Robert Tampé og Ralph Wieneke fra Goethe University Frankfurt, muliggør nu første gang præcis identifikation og kvantificering af interaktioner mellem en receptor med to ligander samtidigt. Den nye metode er blevet offentliggjort i den seneste udgave af tidsskriftet Naturkommunikation .
Atomic force microscopy (AFM) er en kraftfuld teknik til nanoskala karakterisering af overflader. Det gør brug af en cantilever med en ekstremt fin spids. Kraftdistancekurvebaseret atomkraftmikroskopi (FD-baseret AFM) kombinerer højopløselig billeddannelse og enkeltmolekylær kraftspektroskopi. I undersøgelser med biologiske prøver, AFM -spidsen nærmer sig og trækker sig tilbage fra prøven for hver pixel. FD-baserede AFM-metoder bruger forskellige belægninger af AFM-spidsen som værktøjskasse, og sådanne metoder har gjort imponerende fremskridt i de seneste år. Til påvisning af specifikke bindingssteder kræver FD-baseret AFM tøjring af en ligand til AFM-spidsen. Mens konturering af proteinkomplekser i en membran kan sådanne funktionaliserede AFM -spidser derefter måle interaktionen mellem den bundne ligand og proteinet. Det havde ikke været muligt at forestille enkeltmembranreceptorer og samtidig påvise deres interaktioner med mere end en ligand, men den nye metode har overvundet denne forhindring.
Til deres principielle bevis brugte forskerne den humane protease-aktiverede receptor 1 (PAR1), en af den store familie af G-proteinkoblede membranreceptorer. GPCR'er formidler de fleste cellulære reaktioner på hormoner og neurotransmittere, samt at være ansvarlig for vision, smag og smag. GPCR'er kan sameksistere i forskellige funktionelle tilstande i cellemembranen og kan binde forskellige ligander med forskellig styrke eller affinitet. GPCR PAR1 aktiveres af koagulationsprotease -thrombin, der udløser signaleringskaskader til at starte cellulære reaktioner, der hjælper med at orkestrere hæmostase, trombose, betændelse og muligvis også vævsreparation. Ved hjælp af deres nye FD-baserede AFM-metode kunne menneskeligt PAR1 i proteoliposomer afbildes, samtidig med at det påviste ekstracellulære og intracellulære interaktioner af PAR1 med to ligander. Den udviklede overfladekemi og nanoskopiske metode kan anvendes på en række biologiske systemer in vitro og in vivo.
 Varme artikler
Varme artikler
-
 Sølv beviser sin evne til nanoteknologiske applikationerEn lang enkelt DNA-streng er blevet foldet til en trekantet byggeplatform gennem en proces kendt som DNA-origami. Dette arkitektoniske fundament blev derefter dekoreret med en, to eller tre sølv nanop
Sølv beviser sin evne til nanoteknologiske applikationerEn lang enkelt DNA-streng er blevet foldet til en trekantet byggeplatform gennem en proces kendt som DNA-origami. Dette arkitektoniske fundament blev derefter dekoreret med en, to eller tre sølv nanop -
 Ny teknik giver masser af information fra nanoskala knogleprøverEn ny teknik udviklet ved Rensselaer Polytechnic Institute giver forskere mulighed for at indsamle store mængder biokemisk information fra nanoskala knogleprøver. På billedet ses en human kortikal kno
Ny teknik giver masser af information fra nanoskala knogleprøverEn ny teknik udviklet ved Rensselaer Polytechnic Institute giver forskere mulighed for at indsamle store mængder biokemisk information fra nanoskala knogleprøver. På billedet ses en human kortikal kno -
 Glem wearables:Fremtidigt vaskbart smart tøj drevet af Wi-Fi vil overvåge dit helbredFingerspidserne af en trådløs spændingsdetektionshandske lyser, når brugerens hånd nærmer sig et strømførende kabel. Kredit:Purdue University/Rebecca McElhoe Ingeniører fra Purdue University har u
Glem wearables:Fremtidigt vaskbart smart tøj drevet af Wi-Fi vil overvåge dit helbredFingerspidserne af en trådløs spændingsdetektionshandske lyser, når brugerens hånd nærmer sig et strømførende kabel. Kredit:Purdue University/Rebecca McElhoe Ingeniører fra Purdue University har u -
 Nanopartikler til rent drikkevandEn måde at fjerne skadeligt nitrat fra drikkevand på er at katalysere dets omdannelse til nitrogen. Denne proces lider af den ulempe, at den ofte producerer ammoniak. Ved at bruge palladiumnanopartikl
Nanopartikler til rent drikkevandEn måde at fjerne skadeligt nitrat fra drikkevand på er at katalysere dets omdannelse til nitrogen. Denne proces lider af den ulempe, at den ofte producerer ammoniak. Ved at bruge palladiumnanopartikl
- To hjerneområder interagerer for at hjælpe finker med at vide, hvornår og hvordan de skal skrædd…
- Hjælper blinde med at navigere
- Hvordan laver man et bedre vandfilter? Vend den ud og ind
- NASA udvælger fire mulige missioner for at studere solsystemets hemmeligheder
- Lukning af terahertz -hullet:Lille laser er et vigtigt skridt i retning af nye sensorer
- Boring i mysterierne om seismisk aktivitet


