Forskere bruger lys til at skifte viral aktivitet og levere last til celler
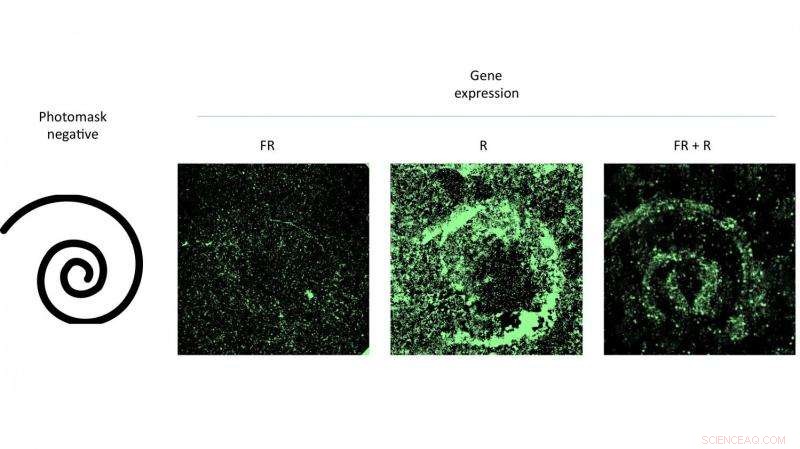
At ramme en petriskål af celler, der indeholdt en modificeret virus med mønstret rødt lys, fremmede genekspression, der matchede mønsteret. Eksperimentet udført af forskere ved Rice University beviste effektiviteten af et nyt genleveringssystem, der kan kontrolleres med lys. Kredit:Eric Gomez/Rice University
Light hjælper Rice University-forskere med at kontrollere både viruss infektivitet og genlevering til kernerne af målceller.
Forskerne har udviklet en metode til at bruge to nuancer af rød til at kontrollere niveauet og den rumlige fordeling af genekspression i celler via en konstrueret virus.
Selvom vira har udviklet sig til at levere gener til værtsceller, de har stadig vanskeligheder med at få deres nyttelast fra cytoplasmaet ind i en celles kerne, hvor genekspression finder sted. Bioingeniørernes Rice-laboratorier Junghae Suh og Jeffrey Tabor har med succes fundet en måde at overvinde denne kritiske forhindring.
Holdets forskning vises i denne uge i tidsskriftet American Chemical Society ACS Nano .
Resultatet fra laboratorier ved Rices BioScience Research Collaborative kombinerer Suhs interesse i at designe vira til at levere gener til målceller med Tabors færdigheder inden for optogenetik, hvor lys-responsive proteiner kan bruges til at kontrollere biologisk adfærd.
De byggede brugerdefinerede adeno-associerede virus-vektorer (AAV) ved at inkorporere proteiner, der naturligt kommer sammen, når de udsættes for rødt lys (650 nanometer bølgelængder) og går i stykker, når de udsættes for langt rødt (750 nanometer bølgelængder). Disse naturligt lys-responsive proteiner hjælper de virale kapsider - de hårde skaller, der indeholder genetiske nyttelaster - med at trænge ind i værtscellekernerne.
AAV har været den foretrukne vektor til genredigering ved hjælp af CRISPR/Cas9, en teknik, der viser løfte om at helbrede nogle genetiske sygdomme, men cellekerner udgør et problem, sagde Suh.

Rice University-studerende Eric Gomez holder en spiralmønstret maske, som han brugte til at kontrollere genekspressionsmønstre i en petriskål. Celler i skålen indeholdt en modificeret virus, der reagerede på rødt lys og leverede deres genetiske last til cellekernerne. Kredit:Jeff Fitlow/Rice University
"Virus generelt er relativt effektive til at levere gener ind i celler, men de oplever stadig store begrænsende barrierer, " sagde hun. "Hvis du tilføjer disse vira til celler, de fleste af dem ser ud til at hænge uden for kernen, og kun en lille del kommer ind, som er målet."
Hun sagde, at holdet trak på Tabor-laboratoriets ekspertise inden for optogenetik for at øge AAV'ernes effektivitet. "Jeff arbejder med mange forskellige typer af lys-responsive proteiner. Det særlige par, vi besluttede os for, blev først identificeret i planter.
"Lys er virkelig rart, fordi du kan anvende det eksternt, og du kan kontrollere mange aspekter:på hvilke områder lyset udsættes, eksponeringens varighed, intensiteten af lyset og, selvfølgelig, dens bølgelængde, " hun sagde.
Proteinparret omfatter phytochrom B og dets bindingspartner phytochrom interagerende faktor 6 (PIF6), begge fundet i thalekarse. Forskerne genererede værtsceller, der udtrykker phytochrom B mærket med en nuklear lokaliseringssekvens, et lille peptid, der er kendt for at hjælpe med at transportere proteiner ind i kernen mere effektivt. Det mindre PIF6 blev derefter fæstnet til den udvendige overflade af viruscapsidet.
"Når vira bliver internaliseret i en værtscelle, de akkumuleres omkring kernen naturligt, " sagde Suh. "Under ikke-aktiverede forhold, de fleste af vira sidder fast der. Men når vi lyser aktiverende rødt lys på cellerne, disse to planteproteiner dimeriserer - de kommer sammen - og på grund af det nukleare lokaliseringsmærke på phytochrome B, virussen trækkes ind i kernen."
Dette er første gang optogenetiske proteiner er blevet brugt til at kontrollere infektiviteten af vira, hun sagde, tilføjer, "Vi troede ikke, det ville fungere så godt, som det gjorde."

Rice University bioingeniør Junghae Suh, venstre, og kandidatstuderende Eric Gomez ledede en undersøgelse, hvor proteiner, der reagerer på lys, hjalp virale kapsider med at levere deres indhold til cellekernerne. Forskerne ser deres teknik som en måde at kontrollere genekspression på. Kredit:Jeff Fitlow/Rice University
Hovedforfatter Eric Gomez, en kandidatstuderende i Suhs laboratorium, og medforfatter Karl Gerhardt, en kandidatstuderende i Tabors laboratorium, demonstrerede teknikken ved at aktivere mønstre af AAV-inficerede celler i petriskåle ved at skinne rødt lys mod dem gennem masker.
Suh sagde, at platformen kan blive brugt i fremtiden til at kontrollere, hvilke celler og væv der udtrykker et gen og på hvilket niveau. Strategien kan også finde anvendelse i vævstekniske applikationer som biostilladser til implantation. "Her, du måske ønsker at lokke stamceller til at udvikle sig til de rigtige celler på en form for rumligt koordineret måde, " hun sagde.
Brug i kroppen er længere væk, fordi eksternt påført rødt lys kun går så langt gennem væv for at nå mål. "Ultimativt, det kommer til at afhænge af den enhed du bruger til at levere lyset, " sagde hun. "Men vi forestiller os tilfælde, hvor du kunne bruge et kateter til at gå til det sted, hvor du ønsker, at vira skal være meget mere smitsom."
Suh sagde, at Rice-laboratorierne arbejder på at gøre den næste generation af capsider både mere effektive og mere leveringsdygtige. "Dette er kun det første skridt, " sagde hun. "Vi har mange spørgsmål, som 'Kan vi virkelig gøre dette in vivo?' slags spørgsmål.
"Der har været en håndfuld papirer, der har forsøgt at få den virusinfektiøse proces til at reagere på lys, men de var før optogenetikkens æra, " sagde Suh. "De brugte andre typer syntetiske molekyler til at gøre vira lysfølsomme.
"Det ser ud til, at det fungerer rigtig godt for os at bruge, hvad Moder Natur allerede har leveret i form af lys-responsive proteiner."
 Varme artikler
Varme artikler
-
 Paraffin-infunderet porøs grafenfilm (PIPGF) med programmerbar fugtbarhedSkematisk diagram af fremstilling af PIPGF med programmerbar befugtning. A) indstillelig befugtning af PIPGF kan fjernstyres ved hjælp af NIR-lys. B) programmerbare befugtningsveje på overfladen af
Paraffin-infunderet porøs grafenfilm (PIPGF) med programmerbar fugtbarhedSkematisk diagram af fremstilling af PIPGF med programmerbar befugtning. A) indstillelig befugtning af PIPGF kan fjernstyres ved hjælp af NIR-lys. B) programmerbare befugtningsveje på overfladen af -
 Forskere overvinder flaskehalse ved fremstilling af kvanteprikkerForskerne demonstrerede den nye storskala quantum dot-mønstermetode ved at lave et billede af kunstværket af Marilyn Monroe af Andy Warhol (1967) på 4-in. kvarts wafer, ses her under UV -lampe excitat
Forskere overvinder flaskehalse ved fremstilling af kvanteprikkerForskerne demonstrerede den nye storskala quantum dot-mønstermetode ved at lave et billede af kunstværket af Marilyn Monroe af Andy Warhol (1967) på 4-in. kvarts wafer, ses her under UV -lampe excitat -
 Nanostrukturer filtrerer lys efter bestillingÆndring af størrelsen og adskillelsen af disse nanoskalaspejle ændrer farven på lyset, som de reflekterer. Arrays af nanoskala søjler lavet til at reflektere lys af en valgt farve kunne finde an
Nanostrukturer filtrerer lys efter bestillingÆndring af størrelsen og adskillelsen af disse nanoskalaspejle ændrer farven på lyset, som de reflekterer. Arrays af nanoskala søjler lavet til at reflektere lys af en valgt farve kunne finde an -
 Udvinding af funktionelle mitokondrier ved hjælp af mikrofluidiske enhedera) Celler indføres i krydsforbindelsen af mikrokanalen. Stresset på cellen er optimeret til at forstyrre cellemembranen og frigive subcellulære komponenter, samtidig med at mitokondriernes integrite
Udvinding af funktionelle mitokondrier ved hjælp af mikrofluidiske enhedera) Celler indføres i krydsforbindelsen af mikrokanalen. Stresset på cellen er optimeret til at forstyrre cellemembranen og frigive subcellulære komponenter, samtidig med at mitokondriernes integrite
- Titans-flodkort kan rådgive Dragonflys sedimentelle rejse
- Hørelidelser kan behandles med multifunktionel nanoliposomterapi
- Ændre din kost for at spare både vand og dit helbred
- NASA opdager den kortvarige tropiske cyklon Maarutha
- Nanotynd piezoelektrik fremmer selvdrevet elektronik
- Havisen forhindrede ilt i at nå dybhavet under sidste istid


