Udvinding af funktionelle mitokondrier ved hjælp af mikrofluidiske enheder
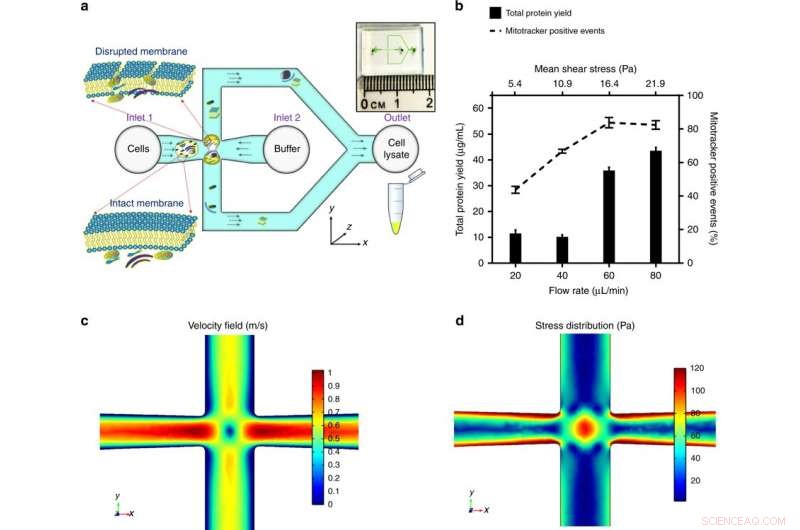
a) Celler indføres i krydsforbindelsen af mikrokanalen. Stresset på cellen er optimeret til at forstyrre cellemembranen og frigive subcellulære komponenter, samtidig med at mitokondriernes integritet bevares. Oversigten over mikrofluidikchippen er vist i indsættelsen. b) Den anvendte middelspænding, moduleret ved at kontrollere den volumetriske strømningshastighed for en given kanalgeometri, er blevet optimeret af det maksimale proteinudbytte (en indikation af mængden af det ekstraherede subcellulære indhold) og de maksimale mitotracker-positive hændelser (et kendetegn for funktionelle mitokondrier). Resultater blev opnået ved at makulere HEK293-celler (embryonale nyreceller, 106 celler/mL) ved en række forskydningsspændinger og plottet som middel ± SD (n = 3 uafhængige eksperimenter). En finite element simuleringsmodel blev etableret af COMSOL Multiphysics® for at illustrere det fluidiske flow ved krydskrydset. Angiv en volumetrisk strømningshastighed på 60 μl/min. c) illustrerer hastighedsprofilen og stagnationspunktet i midten (hvor strømningshastigheden er nul), og d) illustrerer spændingsfordelingen og de ekstensionelle strømningsfelter omkring stagnationspunktet, hvilket bidrager væsentligt til cellens deformation og forstyrrelse. Kredit:Microsystems &Nanoengineering, doi:https://doi.org/10.1038/s41378-018-0037-y.
Mitokondrier er dynamiske, bioenergetiske intracellulære organeller, ansvarlig for energiproduktion via ATP-produktion under respiration. De er involveret i centrale cellulære metaboliske opgaver, der regulerer vitale fysiologiske reaktioner fra celler, herunder cellesignalering, celledifferentiering og celledød. Defekte mitokondrier er forbundet med flere kritiske menneskelige genetiske sygdomme, herunder neurodegenerative lidelser, kræft og hjerte-kar-sygdomme.
Den detaljerede karakterisering af funktionelle mitokondrier forbliver relativt uudforsket på grund af mangel på effektive organelleekstraktionsmetoder. For eksempel, ekstraktionsprocessen skal opretholde tilstrækkelig funktionalitet af organellen ex vivo til at belyse deres cytosoliske funktioner i nærvær af cytoskelet og andre subcellulære organeller. Da mitokondrier vokser i et komplekst retikulært netværk i celler for at gennemgå strukturelle vekslen, deres intracellulære karakterisering er yderligere kompliceret. Som resultat, in vitro analyse af mitokondrier forbliver den almindelige metode, at separat udtrække og forstå mitokondriers iboende egenskaber, uden interferens fra andre subcellulære organeller.
I en nylig undersøgelse, nu udgivet i Mikrosystemer og nanoteknik , Habibur Rahman og kolleger ved Institut for Biomedicinsk Teknik undersøgte muligheden for at kontrollere hydrodynamisk stress for effektiv mitokondriel ekstraktion. For det, de brugte cross-junction mikrofluidisk geometri på mikroskala til selektivt at forstyrre den cellulære membran, mens de sikrede mitokondriemembranens integritet.
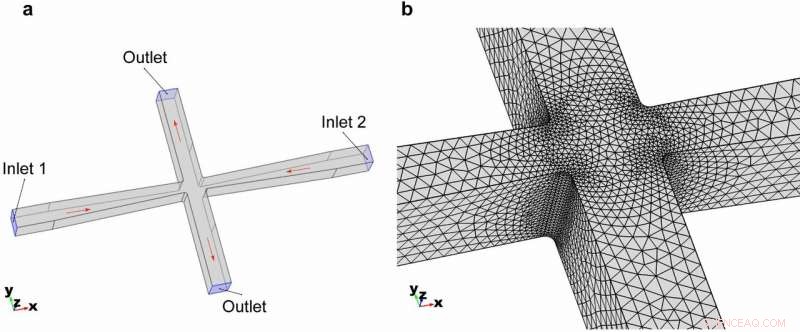
3D-geometri af cross-slot mikrofluidikkanalen. (a) Overordnet geometri og modellens randbetingelser. (b) Sammenkobling af elementerne som zoomet ind i tværspalteområdet. Kredit:Microsystems &Nanoengineering, doi:https://doi.org/10.1038/s41378-018-0037-y
Fremskridt inden for mikrofluidik har vist fordelene ved on-chip laboratorieprocedurer med signifikant reduceret prøvestørrelse og øget eksperimentel reproducerbarhed. Hydrodynamisk stress produceret i mikrofluidchips kan bruges til at åbne cellulære eller nukleare membraner forbigående under intracellulær genlevering. Potentialet af sådanne teknikker er sjældent blevet undersøgt for at udvinde subcellulære organeller, da de begrænsede geometrier af mikrokanaler kan forårsage tilstopning af subcellulære komponenter i mikromaskinerne.
Forfatterne optimerede de eksperimentelle driftsbetingelser baseret på tidligere undersøgelser for effektivt at makulere cellemembraner, mens de bibeholdt intakte mitokondrier i modelpattedyrcellelinjer. Modelcellelinjerne af interesse var humane embryonale nyreceller (HEK293), musemuskelceller (C2C12) og neuroblastomceller (SH-SY5Y).
I arbejdsprincippet for den foreslåede mikroskala-celle-shredder, forskerne målte forskellen i elasticitetsmodul mellem mitokondriemembranen og cellemembranen for at forstyrre cellen, samtidig med at mitokondriemembranen bibeholdtes. Et øget stressniveau i systemet kan forstyrre cellemembraner med højere elasticitetsmoduler (som set med neuroblastomcellelinjen). Undersøgelsen sammenlignede proteinudbyttet og koncentrationen af ekstraherede funktionelle mitokondrier ved hjælp af den foreslåede metode vs. kommercielt tilgængelige kits for en række cellekoncentrationer.
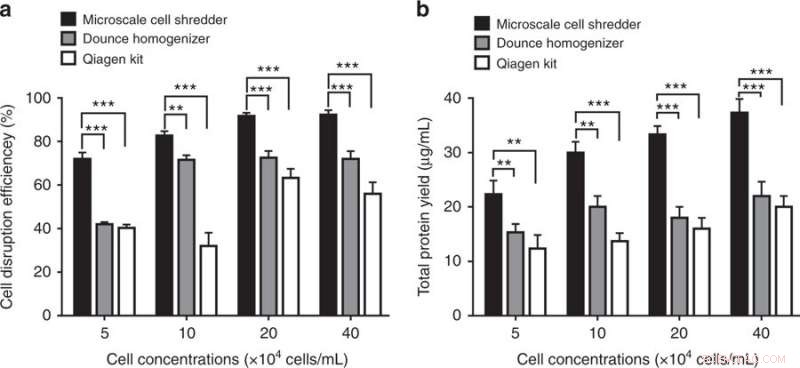
Celleforstyrrelse og proteinekstraktionseffektivitet ved hjælp af mikroskala-cellemakulatoren, Dounce Homogenizer og Qiagen Mitochondria Isolation Kit. a) Celleafbrydelseseffektivitet, bestemt af andelen af ødelagte celler i forhold til det samlede antal intakte celler, blev kvantificeret ved forskellige cellekoncentrationer. b) Efter centrifugeringstrinene, totalt proteinudbytte blev bestemt i overensstemmelse hermed. Disse eksperimenter blev udført under anvendelse af HEK293-celler. Resultater blev plottet som middel ± SD (n = 3 uafhængige eksperimenter, **P < 0,01, ***P < 0,001). Kredit:Microsystems &Nanoengineering, doi:https://doi.org/10.1038/s41378-018-0037-y.
Resultaterne viste, at den foreslåede mikroskala-celle-shreddermetode var mere effektiv end de kommercielle kits ved at give cirka 40 procent mere funktionelle mitokondrier. Forskerne var i stand til at bevare den strukturelle integritet af de ekstraherede organeller selv ved lave cellekoncentrationer. Metoden kunne hurtigt behandle en begrænset mængde prøver (200 µl).
De detaljerede resultater var en første i undersøgelsen demonstration af intakt og funktionel mitokondrier ekstraktion ved hjælp af mikroskala hydrodynamisk stress. Muligheden for at behandle en lav koncentration og lille prøvestørrelse er gunstig til kliniske undersøgelser af mitokondriel sygdom. For at teste den spænding, der udøves af det designede krydskryds, de brugte først en COMSOL Multiphysics-simuleringsmodel. Derefter, Rahman et al. eksperimentelt bestemt den volumetriske strømningshastighed for tre modelcellelinjer. Under eksperimentel cellemembranafbrydelse, under middel forskydningsspænding (16,4 Pa, for en flowhastighed på 60 µL/min.), subcellulære organeller blev frigivet og detekteret med øgede mitokondrielle positive signaler.
Forskerne sammenlignede kapaciteten af den miniaturiserede celle-shredder med kapaciteten af to kommercielle sæt:Dounce-homogenisatoren (mekanisk metode til celleafbrydelse) og Qproteome-mitokondrierisoleringssættet (kemisk metode til celleafbrydelse) til at udvinde mitokondrier. For at bestemme antallet af funktionelle mitokondrier ekstraheret, forskerne brugte MitoTracker - et fluorescerende farvestof, der farver mitokondrier under flowcytometrisk analyse. Resultaterne viste, at mikroskala-celle-shredderen var i stand til at udvinde 40 procent flere funktionelle mitokondrier sammenlignet med de kommercielle kits til både HEK 293- og C2C12-celler.
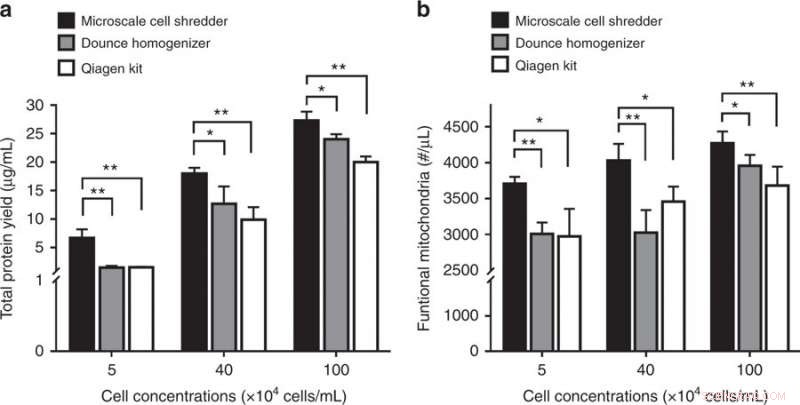
Afbrydelse af neuroblastomceller (SH-SY5Y) og den efterfølgende mitokondrielle ekstraktion. a Totalt proteinudbytte og b-koncentrationer af funktionelle mitokondrier opnået fra de tre ekstraktionsmetoder. Resultater blev plottet som middel ± SD (n = 3 uafhængige eksperimenter, *P < 0,05, **P < 0,01). Kredit:Microsystems &Nanoengineering, doi:https://doi.org/10.1038/s41378-018-0037-y.
Rahman et al. udførte citratsyntaseanalysen for at bestemme mitokondriel integritet gennem enzymatisk aktivitet af beskadigede mitokondrier. Som før, sammenlignet med de kommercielle sæt, mitokondriel integritet var højere for dem, der blev ekstraheret ved hjælp af mikroskala-shredderen i HEK293- og C2C12-celler.
Undersøgelsen viste vigtigheden af membranstivhed ved at validere det foreslåede koncept til at forstyrre neuroblastomcellemembraner (SH-SY5Y). Da SH-SY5Y-cellemembranen havde et højere elasticitetsmodul end både HEK293- og C2C12-cellelinjer, forskerne var nødt til at optimere den volumetriske flowhastighed i mikroskala-shredderen for effektivt at forstyrre SH-SY5Y-cellemembraner. Igen, sammenlignet med de kommercielle sæt ekstraktioner, ved anvendelse af den foreslåede metode leverede en signifikant højere koncentration af protein og funktionelle mitokondrier til cellelinjen af interesse.

En halssektion er inkluderet i kanaldesignet af mikroskala-celle-shredderen for at sikre, at cellerne er fokuseret lateralt til midten af flowstrømmen i mikrofluidik-bioreaktoren. Kredit:Microsystems &Nanoengineering, doi:https://doi.org/10.1038/s41378-018-0037-y
På denne måde Rahman et al. undersøgte muligheden for at forstyrre cellemembranen for at bevare integriteten af mitokondrielle membraner i forskellige pattedyrmodelcellelinjer. De bestemte den optimale forlængelsesspænding og strømningshastighed inde i en bioreaktor med mikrofluidisk tværsnit, baseret på Young's modul for modelcellelinjen af interesse. Under kanaldesign, forskerne inkluderede en halssektion i den mikrofluidiske bioreaktor fremstillet ved hjælp af blød litografi.
Den foreslåede mikrofluidiske mikroskala-celle-shredder demonstrerede overlegen evne til at udvinde funktionelle mitokondrier og proteiner ved at kontrollere hydrodynamisk stress for første gang, sammenlignet med kommercielt tilgængelige celleorganelekstraktionssæt. Forsøgene var gennemførlige selv med små mængder af prøver (200 µl volumen, indeholdende 10 4 celler/ml) til potentielle kliniske anvendelser. Rahman et al. var i stand til trofast at replikere protokollen på tværs af tre cellelinjer. Det eksperimentelle arbejde kan oversættes til et klinisk miljø for at forstå mitokondrielle dysfunktionsrelaterede lidelser i dybden.
© 2019 Science X Network
Sidste artikelLyse farver produceret ved laseropvarmning
Næste artikelForskere udvikler ny test til at opdage sygdom og infektion
 Varme artikler
Varme artikler
-
 Grafen kunne revolutionere tingenes internetKredit:Thinkstock PFL-forskere har produceret en tunbar, grafen-baseret enhed, der betydeligt kunne øge hastigheden og effektiviteten af trådløse kommunikationssystemer. Deres system fungerer ve
Grafen kunne revolutionere tingenes internetKredit:Thinkstock PFL-forskere har produceret en tunbar, grafen-baseret enhed, der betydeligt kunne øge hastigheden og effektiviteten af trådløse kommunikationssystemer. Deres system fungerer ve -
 Forvandler grafit til diamantSLAC-forskere har fundet en ny måde at omdanne grafit - en ren form for kulstof, der er mest kendt som blyanten i blyanter - til en diamantlignende film. Kredit:Fabricio Sousa/SLAC (Phys.org) – Et
Forvandler grafit til diamantSLAC-forskere har fundet en ny måde at omdanne grafit - en ren form for kulstof, der er mest kendt som blyanten i blyanter - til en diamantlignende film. Kredit:Fabricio Sousa/SLAC (Phys.org) – Et -
 Sådan fortæller du, når en nanopartikel er ude af formNanopartikler (gule) målrettet mod og ind i kræftceller (blå). Kredit:NIH Nanopartikler-dem med diametre mindre end en tusindedel af et menneskehårs bredde-er i stigende grad udbredt inden for høj
Sådan fortæller du, når en nanopartikel er ude af formNanopartikler (gule) målrettet mod og ind i kræftceller (blå). Kredit:NIH Nanopartikler-dem med diametre mindre end en tusindedel af et menneskehårs bredde-er i stigende grad udbredt inden for høj -
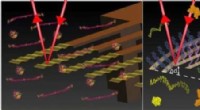 Nanoteknisk diagnostik kan indikere kræft eller trombotisk risiko i en dråbe blodKredit:Trinity College Dublin Et hold af internationale forskere ledet af professor Martin Hegner, Undersøger i CRANN og Trinitys School of Physics, har udviklet en automatiseret diagnostisk platf
Nanoteknisk diagnostik kan indikere kræft eller trombotisk risiko i en dråbe blodKredit:Trinity College Dublin Et hold af internationale forskere ledet af professor Martin Hegner, Undersøger i CRANN og Trinitys School of Physics, har udviklet en automatiseret diagnostisk platf
- Atomkraftværket lukker uventet ned i staten Washington
- Apple afslører en billigere iPhone og priser for streaming af tv
- Mere benplads, mindre samtale for Uber-ryttere, der betaler
- Design af komplekse strukturer ud over mulighederne for konventionel litografi
- Du ville ikke slå en hund, så hvorfor dræbe en i Minecraft? Hvorfor vold mod virtuelle dyr er et …
- Ingeniører skaber den mest slidstærke metallegering i verden


