Udfører mobiloperation med et laserdrevet nanoblade
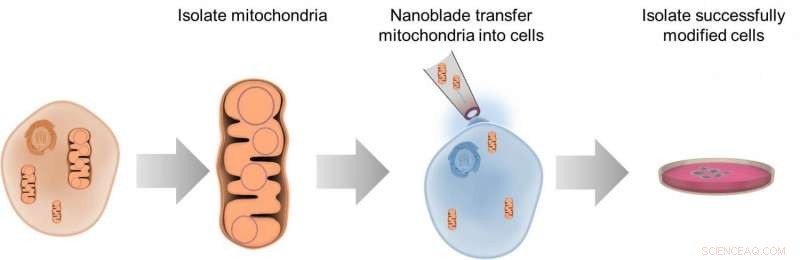
Dette diagram illustrerer processen med overførsel af mitokondrier mellem celler ved hjælp af nanoblade -teknologien. Kredit:Alexander N. Patananan
For at studere visse aspekter af celler, forskere har brug for evnen til at fjerne de inderste ting, manipulere dem, og læg dem tilbage. Mulighederne for denne slags arbejde er begrænsede, men forskere rapporterer 10. maj in Celle metabolisme beskrive en "nanoblade", der kan skære gennem en celles membran for at indsætte mitokondrier. Forskerne har tidligere brugt denne teknologi til at overføre andre materialer mellem celler og håber at kommercialisere nanobladen til bredere brug inden for bioingeniør.
"Som et nyt værktøj til celleteknik, virkelig at konstruere celler til sundhedsformål og forskning, Jeg synes, det er meget unikt, "siger Mike Teitell, en patolog og bioingeniør ved University of California, Los Angeles (UCLA). "Vi er ikke stødt på noget indtil nu, op til et par mikrometer i størrelse, som vi ikke kan levere. ”
Teitell og Pei-Yu "Eric" Chiou, også en bioingeniør ved UCLA, opfattede først ideen om en nanoblade for flere år siden for at overføre en kerne fra en celle til en anden. Imidlertid, de dykkede hurtigt ind i skæringspunktet mellem stamcellebiologi og energimetabolisme, hvor teknologien kunne bruges til at manipulere en celles mitokondrier. Undersøgelse af virkningerne af mutationer i mitokondriegenomet, som kan forårsage invaliderende eller dødelige sygdomme hos mennesker, er vanskelig af flere årsager.
"Der er en flaskehals i feltet til at ændre en celles mitokondrielle DNA, "siger Teitell." Så vi arbejder på en totrinsproces:rediger mitokondrielle genom uden for en celle, og tag derefter de manipulerede mitokondrier og sæt dem tilbage i cellen. Vi arbejder stadig på det første trin, men vi har løst den anden ganske godt. "
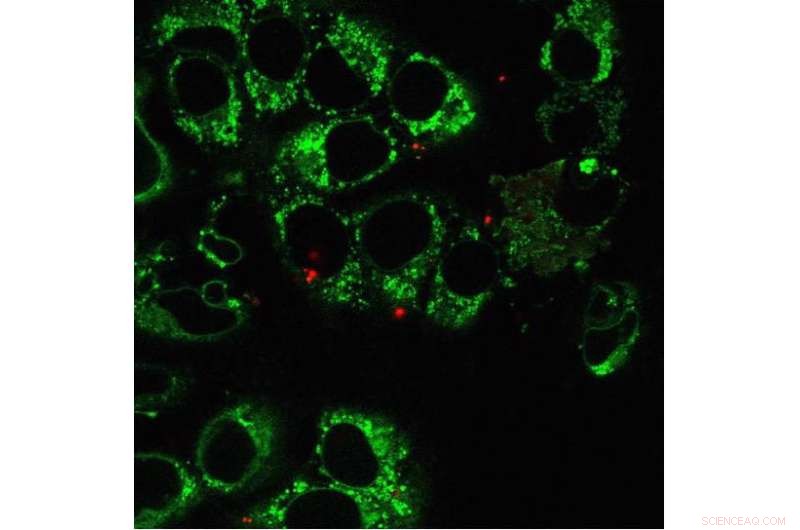
Dette billede viser humane osteosarkomceller og mitokondrier (grøn), med yderligere mitokondrier (rød) fra humane embryonale nyreceller overført via nanobladen. Meget få rødmærkede mitokondrier leveres faktisk af nanobladen til hver celle, sammenlignet med de allerede eksisterende grønne mitokondrier. Over et par uger, mitokondrie-DNA'et i de rødmærkede mitokondrier vil forstærkes massivt. Kredit:Ting-Hsiang Wu
Nanoblade -apparatet består af et mikroskop, laser, og titaniumbelagt mikropipette til at fungere som "bladet, "betjenes ved hjælp af en joystick -controller. Når en laserpuls rammer titanen, metallet varmes op, fordampe de omgivende vandlag i kulturmediet og danne en boble ved siden af en celle. Inden for et mikrosekund, boblen udvider sig, genererer en lokal kraft, der punkterer cellemembranen og skaber en passage, der er flere mikron lang, som "lasten" - i dette tilfælde, mitokondrier - kan skubbes igennem. Cellen reparerer derefter membranfejlen hurtigt.
Teitell, Chiou, og deres team brugte nanobladen til at indsætte mærkede mitokondrier fra humane brystkræftceller og embryonale nyreceller i celler uden mitokondrielt DNA. Da de efterfølgende sekventerede det nukleare og mitokondrielle DNA, forskerne så, at mitokondrierne var blevet overført og replikeret med succes af 2% af cellerne, med en række funktioner. Andre metoder til mitokondriel overførsel er svære at kontrollere, og når de er blevet rapporteret til at fungere, succesraterne har kun været 0,0001% -0,5% ifølge forskerne.
"Succesen med mitokondrieoverførslen var meget opmuntrende, "siger Chiou." Den mest spændende applikation til nanoblade, til mig, er i undersøgelsen af mitokondrier og infektionssygdomme. Denne teknologi bringer nye muligheder til at hjælpe med at fremme disse felter. "
Teamets ambitioner går også langt ud over mitokondrier, og de har allerede opskaleret nanoblade-apparatet til en automatiseret version med høj kapacitet. "Vi ønsker at lave en platform, der er let at bruge for alle og give forskere mulighed for at udtænke alt, hvad de kan tænke på et par mikron eller mindre, som ville være nyttigt for deres forskning - uanset om det er at indsætte antistoffer, bakterier, syntetiske materialer, eller noget andet, som vi ikke har forestillet os, "siger Teitell." Det ville være meget fedt at tillade folk at gøre noget, som de ikke kan gøre lige nu. "
 Varme artikler
Varme artikler
-
 Nanotech forbedrer cystisk fibrose-antibiotikum med 100, 000 gangeKredit:Shutterstock Verdens første nanoteknologi udviklet af University of South Australia kan ændre livet for tusindvis af mennesker, der lever med cystisk fibrose (CF), som viser, at det kan for
Nanotech forbedrer cystisk fibrose-antibiotikum med 100, 000 gangeKredit:Shutterstock Verdens første nanoteknologi udviklet af University of South Australia kan ændre livet for tusindvis af mennesker, der lever med cystisk fibrose (CF), som viser, at det kan for -
 To forskellige kollektive oscillationer af elektroner, der forekommer på guldnanopartikler, observe…Fig. 1 (a) Diagram af målesystemet til at observere henfaldsprocessen af elektronens kollektive bevægelse. Laserstrålen til fotoemissionselektronmikroskopet er opdelt i to, og ved at forsinke tiden
To forskellige kollektive oscillationer af elektroner, der forekommer på guldnanopartikler, observe…Fig. 1 (a) Diagram af målesystemet til at observere henfaldsprocessen af elektronens kollektive bevægelse. Laserstrålen til fotoemissionselektronmikroskopet er opdelt i to, og ved at forsinke tiden -
 Verdens mindste bladomslag måler 11 x 14 mikrometer (m/ video)National Geographic Kids hævdede i dag sin niende GUINNESS WORLD RECORDS® -titel for det mindste bladomslag, ved hjælp af teknologi fra IBM, på USA Science &Engineering Festival i Washington, D.C. For
Verdens mindste bladomslag måler 11 x 14 mikrometer (m/ video)National Geographic Kids hævdede i dag sin niende GUINNESS WORLD RECORDS® -titel for det mindste bladomslag, ved hjælp af teknologi fra IBM, på USA Science &Engineering Festival i Washington, D.C. For -
 Mindst mulige diamanter danner ultratynde nanotrådeFor første gang, videnskabsmænd har opdaget, hvordan man producerer ultratynde diamant nanotråde, der lover ekstraordinære egenskaber, inklusive styrke og stivhed større end nutidens stærkeste nanorør
Mindst mulige diamanter danner ultratynde nanotrådeFor første gang, videnskabsmænd har opdaget, hvordan man producerer ultratynde diamant nanotråde, der lover ekstraordinære egenskaber, inklusive styrke og stivhed større end nutidens stærkeste nanorør
- Formel for en Octagon
- Nanopartikler kan have større indvirkning på miljøet end tidligere antaget
- Fysikere beskriver en ny type nordlys
- Forskere identificerer almindeligt oversete nøgleegenskaber ved effektive ledere
- Hvordan bruger astronauter trigonometri?
- Amazon øger autoambitionerne med in-car TV, Alexa integration


