Nyt nanopartikelbaseret kontrastmiddel, der er pH-afhængigt
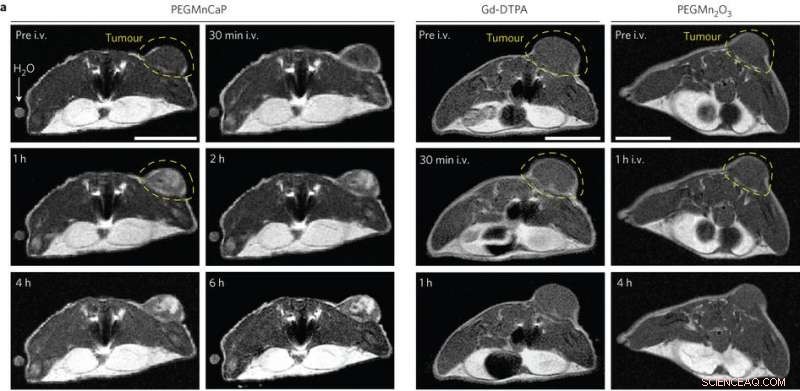
In vivo MR-billeder af subkutane C26-tumorbærende mus præ- og post-intravenøs injektion (i.v.) af PEGMnCaP (venstre), Gd-DTPA (i midten) og PEGMn2O3 (højre) målt med 1 T MRI. Kun PEGMnCaP viste en selektiv og høj forbedring af tumorkontrast. Målestok, 1 cm. Kredit:(c) Peng Mi et al, Natur nanoteknologi (2016). DOI:10.1038/nnano.2016.72
(Phys.org) - En ny type nanopartikel-baseret MRI-kontrastmiddel demonstrerer selektivitet for tumorceller i forhold til ikke-kræftceller, kan påvise hypoxi, og er følsom nok til at påvise svære at finde kræftceller ifølge en undersøgelse i Natur nanoteknologi .
Forskere fra University of Tokyo, Tokyo Institute of Technology, Kawasaki Institute of Industry Promotion, og Japan Agency for Quantum and Radiological Science and Technology har udviklet et kontrastmiddel fra calciumphosphat-baserede nanopartikler, der frigiver en manganion i et surt miljø. Manganionen binder sig derefter til proteiner, hvilket giver mulighed for et stærkere kontrastsignal, der varer længere end de nuværende klinisk godkendte alternativer. Disse nanopartikel-baserede kontrastmidler er også funktionaliserede med en poly(ethylenglycol)-skal, der fremmer tilknytning til kræftcellen.
Magnetisk resonansbilleddannelse er afhængig af excitation og efterfølgende afslapning af protoner. I kliniske MR-undersøgelser, signalet er bestemt af relaksationstiden for brintprotonerne i vand. For at få et stærkere signal, forskere kan bruge kontrastmidler til at forkorte protonernes afslapningstid.
MR er ikke-invasiv og involverer ikke stråling, gør det til et sikkert diagnoseværktøj. Imidlertid, dets svage signal gør tumordetektion vanskelig. Det ideelle kontrastmiddel vil vælge til ondartede tumorer, gør dets placering og diagnose meget mere indlysende.
Nanopartikelkontrastmidler har været af interesse, fordi nanopartikler kan funktionaliseres og, som i denne undersøgelse, kan indeholde forskellige metaller. Forskere har forsøgt at funktionalisere nanopartikler med ligander, der binder sig til kemiske faktorer på overfladen af kræftceller. Imidlertid, kræftceller har en tendens til at være sammensat heterogene, får nogle forskere til at lede efter nanopartikler, der reagerer på forskelle i pH eller redoxpotentiale sammenlignet med normale celler.
Peng Mi, Daisuke Kokuryo, Horacio Cabral, Hailiang Wu, Yasuko Terada, Tsuneo Saga, Ichio Aoki, Nobuhiro Nishiyama, og Kazunori Kataoka udviklede et kontrastmiddel, der består af Mn 2+ - dopede CaP nanopartikler med en PEG-skal. De begrundede, at brug af CaP nanopartikler, som er kendt for at være pH-følsomme, ville tillade den målrettede frigivelse af Mn 2+ ioner i tumormikromiljøet. Tumormikromiljøet har en tendens til at have en lavere pH end de normale regioner til hurtig cellemetabolisme i et iltfattigt miljø. Manganioner blev testet, fordi de er paramagnetiske, hvilket giver et godt kontrastmiddel. De binder sig også til proteiner og skaber et langsomt roterende mangan-proteinsystem, der resulterer i skarp kontrastforøgelse.
Studier med CaPMnPEG nanopartikler viste, at nanopartiklerne er stabile under fysiologiske forhold (pH 7,4) og kun 8 % af Mn 2+ ioner blev frigivet under disse forhold. Under forhold, der efterligner tumormikromiljøet og det intercellulære miljø, inden for fire timer 36% af Mn 2+ ioner blev frigivet ved pH 6,7, 71 % ved pH 6,5, og over 90 % ved pH 5.
Derudover forsøg med CaPMnPEG og humant serumalbumin (HSA) i et surt medium viste signifikant signalforstærkning. Dette skyldes proteinbinding af Mn 2+ ion, hvilket i høj grad øgede ionens molekylære relaxivitet.
Disse resultater var lovende, så Peng Mi, et al. testede derefter, om CaPMnPEG-kontrastmidlet virkede i solide tumorer. Fordi Mn 2+ forbliver indespærret i nanopartikelmatrixen ved fysiologisk pH, CaPMnPEG viser en meget lavere toksicitet sammenlignet med MnCl 2 . MR-undersøgelser viste en tumor-til-normal kontrast på 131 % efter 30 minutter, som er meget højere end Gd-DTPA, et klinisk godkendt kontrastmiddel. Efter en time, tumor-til-normal-forholdet var 160 % og forblev omkring 170 % i flere timer.
Tredimensionelle MR-undersøgelser af solide tumorer viste, at uden tilsætning af CaPMnPEG, kun blodkar var synlige. Imidlertid, ved tilføjelse af CaPMnPEG, tumoren var let at skelne. Derudover der er bevis for, at overskydende Mn 2+ forlader plasmaet efter en time. Kontrastsignalet forblev stærkt i adskillige timer, hvilket indikerer, at proteinbinding snarere end Mn 2+ koncentration er vigtig for signalforstærkning.
Især der var lysere kontrastforstærkende områder på tumoren. Yderligere eksperimenter viste, at regioner med højere kontrast korrelerede med tumorhypoxi. Ondartede tumorer har tendens til at være hypoksiske, hvilket fører til en ophobning af laktat. Dette resulterer i at sænke pH. Andre teknikker til at opdage hypoxi har en tendens til kun at se på overfladen af målvævet eller, i tilfælde af PET, involverer stråling og dårlig opløsning. Denne teknik er mere sikker, ikke-invasiv, og ikke begrænset til overfladetumorerne.
Endelig, tests med metastaserende tumorer i leveren (C26 tyktarmskræftceller) viste, at CaPMnPEG fungerer godt ved analyse af solide organer og er meget følsom over for at påvise mikrometastaser på millimeterstørrelse. I modsætning til andre kontrastmidler, der anvendes i klinikken, CaPMnPEG gav et kontrastsignal, der varede i flere timer efter injektion. Efter en time, signalet blev forstærket med 25 % og efter to timer, signalet blev forbedret med 39 %.
Denne forskning rapporterer udviklingen og karakteriseringen af et lovende nyt kontrastmiddel, der kan give bedre tumordetektion og diagnose. Yderligere undersøgelser kunne involvere at teste dette kontrastmiddel med andre sygdomme, der forårsager fysiologiske ændringer i pH samt in vivo overvågning af nye lægemidler.
© 2016 Phys.org
Sidste artikelNyt materiale dræber E. coli-bakterier på 30 sekunder
Næste artikelSuperfilter nanomaske beskytter mod usynlige dræbere
 Varme artikler
Varme artikler
-
 Engineering selvsamlende amyloidfibreAmyloidfibre samler sig selv fra mindre proteiner. UC Davis forskere har konstrueret andre proteiner, så de spontant danner amyloid. Disse nye proteiner kan være nyttige i nanoteknologi. Her, hættestr
Engineering selvsamlende amyloidfibreAmyloidfibre samler sig selv fra mindre proteiner. UC Davis forskere har konstrueret andre proteiner, så de spontant danner amyloid. Disse nye proteiner kan være nyttige i nanoteknologi. Her, hættestr -
 Papirtynd e-skin reagerer på berøring ved at lyse opDer vises et fuldt fremstillet 16x16 pixel e-skin, der lyser ved berøring. Kredit:Foto af Ali Javey og Chuan Wang En ny milepæl af ingeniører ved University of California, Berkeley, kan hjælpe rob
Papirtynd e-skin reagerer på berøring ved at lyse opDer vises et fuldt fremstillet 16x16 pixel e-skin, der lyser ved berøring. Kredit:Foto af Ali Javey og Chuan Wang En ny milepæl af ingeniører ved University of California, Berkeley, kan hjælpe rob -
 Hybrid energihøster genererer elektricitet fra vibrationer og sollys(a) Diagram af silicium nanopillar solcelle. (b) Diagram af hybridenergihøsteren bestående af en piezoelektrisk nanogenerator integreret på en siliciumnanopillar solcelle. Kredit:Dae-Yeong Lee, et al.
Hybrid energihøster genererer elektricitet fra vibrationer og sollys(a) Diagram af silicium nanopillar solcelle. (b) Diagram af hybridenergihøsteren bestående af en piezoelektrisk nanogenerator integreret på en siliciumnanopillar solcelle. Kredit:Dae-Yeong Lee, et al. -
 Holografisk mikroskop giver et nyt værktøj til nanomedicin til hurtigt at måle nedbrydning af læ…En illustration af en omkostningseffektiv metode til hurtigt at overvåge nedbrydningen af lægemiddelbærende nanopartikler ved hjælp af et mikroskop i chipskala. Kredit:UCLA Ozcan Research Group
Holografisk mikroskop giver et nyt værktøj til nanomedicin til hurtigt at måle nedbrydning af læ…En illustration af en omkostningseffektiv metode til hurtigt at overvåge nedbrydningen af lægemiddelbærende nanopartikler ved hjælp af et mikroskop i chipskala. Kredit:UCLA Ozcan Research Group
- Nyt materiale til behandling af sår kan beskytte mod resistente bakterier
- Små enheder lavet af DNA opdager kræft med færre falske alarmer
- Mindes hullet foran fremtidige brændstoffer
- Bezos, på jagt efter store gevinster, er fortrolig med store fejl (Opdatering)
- Sod -retsmedicin:Kulstof -fingeraftryk afslører buet nanostruktur
- Jordens fremtid bliver skrevet i hurtigt smeltende Grønland


