Første nøjagtige simulering af en virus, der invaderer en celle
For første gang, videnskabsmænd ved, hvad der sker med en viruss form, når den invaderer en værtscelle, takket være et eksperiment udført af forskere ved Penn State College of Medicine og University of Pittsburgh School of Medicine. At forstå, hvordan virusformen ændrer sig, kan føre til mere effektive antivirale terapier.
Eksperimentet var designet til at undersøge, hvordan en viruss proteinskal - dens kapsid - ændrer sig, mens den forbereder sig på at injicere sit genetiske materiale i en celle. Disse ændrede viruspartikler er kendt som A-partikler, eller mellemprodukter til virusindgang.
I tidligere forsøg, udsættelse af en virus for ekstrem varme eller proteiner fik formen på hele kapsiden til at ændre sig. Disse var de nærmeste observerbare simuleringer til en virus, der invaderede en celle, der var udtænkt på det tidspunkt.
"Ved hjælp af disse lab -tricks, mit laboratorium og de af andre forskere var i stand til at skabe strukturer i høj opløsning af de ændrede viruspartikler, men alle disse tricks udløste kapsiden fra alle retninger, " sagde Susan Hafenstein, adjunkt i medicin og mikrobiologi og immunologi, Penn State College of Medicine.
Hafenstein antog, at i en mere realistisk simulering, kun den del af virussen, der interagerede med receptorer på cellen, ville ændre form.
I det nye eksperiment, Hafenstein og hendes medforskere simulerede overfladen af en celle ved at bruge falske membraner kaldet nanodiske. De indsatte humane cellereceptorer proteinmolekyler, der lader udefrakommende signaler komme ind i cellen - ind i nanodiskene, første gang dette er blevet gjort for at fange et viruskapsid. Resultaterne blev rapporteret i en nylig udgave af tidsskriftet Videnskabens fremskridt .
"Denne særlige receptor har en lang hale, som den begraver i cellemembranen, " Hafenstein forklarede. "I vores eksperiment, den begravede halen i nanoskiven, giver os en falsk membran, der viser den passende receptor til at binde til virussen."
Forskerne tilføjede derefter viruscapsider til receptormembranerne og observerede de resulterende ændringer i capsiden ved hjælp af en billedbehandlingsteknik kaldet kryo-elektronmikroskopi.
Da de tusinder af 2D -billeder, de tog, blev samlet igen til et 3D -kapsid - en proces, der lignede en CAT -scanning - fandt de ud af, at tidligere observerede formændringer kun skete på det sted, hvor receptorerne bandt til virussen.
"Vores arbejde viser, at en pore kun åbner sig ved det ene interaktionspunkt med værtscellen, "Sagde Hafenstein." Og det er det, der skal oprette kapsidet til at frigive det genetiske materiale i cellen. Vi tror, vi har fanget den første fysiologisk nøjagtige viruscapsid, der er forberedt til at komme ind i værten. Alle dem, vi tidligere havde undersøgt, viste ændringer, der fandt sted over hele kapsiden."
Et nyligt fremskridt med kryo-elektronmikroskopi-direkte elektronpåvisning-gjorde observationen mulig.
"Denne måde at tage billeder på har givet os mulighed for at tage virkelig hurtige billeder, som derefter kan korrigeres til perfekte data, " sagde Hafenstein. "Nu kan vi få atomopløsning ved hjælp af cryoEM."
Forskerne brugte en virus kaldet coxsackievirus B3 (CVB3) i deres eksperiment. CVB3 er en type picornavirus, en familie af hurtigt muterende små RNA -vira, der forårsager sygdomme lige fra forkølelse til pancreatitis til polio.
RNA-vira - en gruppe, der også inkluderer HIV - ændrer sig hver gang de replikerer. Disse stærkt muterende vira kan undslippe antiviral medicin.
Det ultimative mål er at forstå forviklinger i trinene i virusets livscyklus, såsom hvordan virussen trænger ind i værtscellen, og at lede antivirale midler til disse specifikke trin, sagde Hafenstein. "Derefter, hvis virussen muterer væk for at undslippe stoffet, det vil også miste evnen til at komme ind i cellen."
Næste, Hafensteins gruppe planlægger at bruge en større nanodisk til at fange processen med virussen, der interagerer med den falske membran.
"Fordi nanodiskene i dette sæt eksperimenter var så små, vi får ikke det bedste billede af interaktionen, og det er et sted at forbedre, sagde hun. Dette, hun håber, vil afsløre "det vigtigste trin - at finde ud af, hvad der udløser frigivelsen af RNA i cellen."
 Varme artikler
Varme artikler
-
 En trykfarve, der både er ledende og gennemsigtig, blokerer også for radiobølgerForskerne observerede en signifikant reduktion i signalstyrken fra en mobiltelefon inde i en boks dækket med deres inkjet-printede elektromagnetisk-bølge-blokerende nanotråd-polymer ledende ark. Kredi
En trykfarve, der både er ledende og gennemsigtig, blokerer også for radiobølgerForskerne observerede en signifikant reduktion i signalstyrken fra en mobiltelefon inde i en boks dækket med deres inkjet-printede elektromagnetisk-bølge-blokerende nanotråd-polymer ledende ark. Kredi -
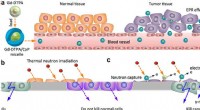 Gadolinium-baserede partikler viser og behandler tumorerSkema af Gd-DTPA/CaP hybridmiceller rettet mod tumorer til gadolinium neutron capture therapy (GdNCT). (a) Akkumuleringen af Gd-DTPA leveret af Gd-DTPA/CaP i tumorer på grund af den forbedrede perme
Gadolinium-baserede partikler viser og behandler tumorerSkema af Gd-DTPA/CaP hybridmiceller rettet mod tumorer til gadolinium neutron capture therapy (GdNCT). (a) Akkumuleringen af Gd-DTPA leveret af Gd-DTPA/CaP i tumorer på grund af den forbedrede perme -
 Grafen ser lovende ud til fremtidige spintronic-enhederForskerne fremstillede spintronics-enhederne på Nano-fabrikationslaboratoriet på Chalmers University of Technology. Fra venstre:Saroj Prasad Dash, Venkata Kamalakar Mutta og André Dankert. Kredit:Osca
Grafen ser lovende ud til fremtidige spintronic-enhederForskerne fremstillede spintronics-enhederne på Nano-fabrikationslaboratoriet på Chalmers University of Technology. Fra venstre:Saroj Prasad Dash, Venkata Kamalakar Mutta og André Dankert. Kredit:Osca -
 Intelligente nanomaterialer til fotonikPh.d.-studerende Quyet Ngo studerer optiske fibre funktionaliserede af 2D-materialer. Kredit:Jens Meyer/University of Jena Siden Nobelprisen i fysik blev tildelt for forskning i grafen i 2010, 2D-
Intelligente nanomaterialer til fotonikPh.d.-studerende Quyet Ngo studerer optiske fibre funktionaliserede af 2D-materialer. Kredit:Jens Meyer/University of Jena Siden Nobelprisen i fysik blev tildelt for forskning i grafen i 2010, 2D-


