Nyt værktøj til at spore cirkulerende kræftceller
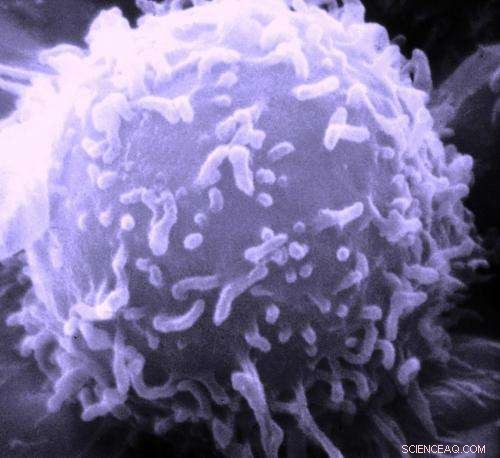
Elektronmikroskopisk billede af en enkelt human lymfocyt. Kredit:Dr. Triche National Cancer Institute
Kræftsvulster er kendt for at frigive celler til blodbanen, og det er disse cirkulerende tumorceller eller CTC'er, der er kilderne til metastatiske tumorer - tumorer, der spredes og dannes på fjerne steder i kroppen. Faktisk, de fleste patienter, der bukker under for kræft, dør ikke på grund af de første tumorer, der dannes, men snarere på grund af de dødelige sekundære metastatiske tumorer, der opstår på fjerne steder. Som resultat, at forstå biologien og den kliniske relevans af disse rejseceller er afgørende i vores kamp mod kræft.
Overvågning af cirkulerende tumorceller, imidlertid, er en enorm udfordring, da de er i undertal i blodet af raske celler på et niveau på over 1 milliard-til-1. I øvrigt, de kan vise varierede og dynamiske egenskaber, og samlingen af CTC'er fundet i blodbanen hos en cancerpatient kan have forskelligt metastatisk potentiale. Følgelig, bestræbelserne på at integrere analysen af disse celler i den almindelige kliniske medicin har været begrænset, fordi det har været vanskeligt at udpege, hvilke typer af celler og hvilke fænotypiske egenskaber, der skal målrettes. Men potentialet for CTC'er til at tillade indsamling af en ikke-invasiv "flydende biopsi" for at overvåge kræftprogression er en fristende mulighed, som er blevet ved med at tiltrække betydelig opmærksomhed på dette problem.
Et gennembrud af professor Shana Kelleys forskningsgruppe ved University of Toronto offentliggjort i Natur nanoteknologi giver et nyt værktøj til at karakterisere CTC'er, der kan hjælpe kræftbiologer og klinikere med at forstå, hvordan man bruger disse celler til at give bedre behandling. Ved hjælp af magnetiske nanopartikler, CTC'er i blodprøver blev målrettet baseret på proteiner vist på celleoverfladen, og adskilt baseret på niveauerne af det tilstedeværende protein. Ved hjælp af en høj opløsning mikrofluidisk enhed, celler adskilles derefter i 100 forskellige indfangningszoner for at generere en profil, der giver fænotypisk information relateret til metastatisk potentiale. Ved hjælp af denne tilgang og overvågning af celler genereret i dyremodeller af kræft og i prøver indsamlet fra prostatakræftpatienter, egenskaberne af CTC'er viste sig at udvikle sig og blive mere aggressive, efterhånden som tumorer blev mere avancerede.
"Gennem denne tilgang, vi havde til formål at tilbyde en ny måde at profilere CTC'er ud over blot at tælle deres antal i kliniske prøver, " forklarede Dr. Mahla Poudineh, hovedstuderende forfatter på papiret. "I stedet, vi ønskede at give phentotypic information, der kunne gøre det muligt for disse celler at blive klassificeret som godartede eller mere farlige, som derefter ville informere behandlingsmulighederne."
"Vi var meget heldige at samarbejde med en række onkologer på Sunnybrook Research Center og Princess Margaret Hospital, da vi udviklede denne teknologi, så vi kunne teste vores tilgang med rigtige patientprøver og bedre forstå, hvordan vi tilpasser den til brug i klinikken, " bemærkede Dr. Kelley.
Kelley -gruppen (www.kelleylaboratory.com/), sammen med samarbejdspartnere i Sargent-gruppen (www.light.utoronto.ca/) ved University of Toronto, håber at gøre den tilgang, de rapporterede om, til en enhed, der kan bruges af kræftforskere og i sidste ende klinikere, så CTC-analyse kan overvåges rutinemæssigt og bruges til at begrænse udviklingen af kræft.
 Varme artikler
Varme artikler
-
 Detektering af kemikalier, måling af stamme med blyant og papirEn belastningsmåler lavet af blyant og papir deformeres for at komprimere grafenetværket. (Phys.org)-Nogle gange kræver løsning af et problem ikke en højteknologisk løsning. Sommetider, du skal ik
Detektering af kemikalier, måling af stamme med blyant og papirEn belastningsmåler lavet af blyant og papir deformeres for at komprimere grafenetværket. (Phys.org)-Nogle gange kræver løsning af et problem ikke en højteknologisk løsning. Sommetider, du skal ik -
 Fysikere styrer lysspredning i grafenEn flage af grafen blev dyrket på kobber og overført til et isolerende substrat af siliciumdioxid. Fermi-energien i grafenen blev justeret ved at variere gate-spændingen på den overliggende iongel, so
Fysikere styrer lysspredning i grafenEn flage af grafen blev dyrket på kobber og overført til et isolerende substrat af siliciumdioxid. Fermi-energien i grafenen blev justeret ved at variere gate-spændingen på den overliggende iongel, so -
 Nano-spejlsalen får molekyler til at blande sig med lysBlanding af lys med farvestofmolekyler, fanget i gyldne huller. Kredit:Yi Ju/University of Cambridge NanoPhotonics Når et molekyle udsender et lysblink, den forventer ikke, at den nogensinde komme
Nano-spejlsalen får molekyler til at blande sig med lysBlanding af lys med farvestofmolekyler, fanget i gyldne huller. Kredit:Yi Ju/University of Cambridge NanoPhotonics Når et molekyle udsender et lysblink, den forventer ikke, at den nogensinde komme -
 Behandling af reumatoid arthritis med mikromotorerHydrogendrevne mikromotorer (illustration, top, og mikroskopbillede, nederst) forbedrede rheumatoid arthritis-symptomer, når de blev injiceret i rotters led. Målestok, 20 μm. Kredit:Tilpasset fra Nan
Behandling af reumatoid arthritis med mikromotorerHydrogendrevne mikromotorer (illustration, top, og mikroskopbillede, nederst) forbedrede rheumatoid arthritis-symptomer, når de blev injiceret i rotters led. Målestok, 20 μm. Kredit:Tilpasset fra Nan
- Forskere gør tantaloxid praktisk til enheder med høj densitet
- Kan du virkelig bekæmpe ild med ild?
- Hvad er en konstant i den videnskabelige metode?
- Ultrasensitive sensorer fremstillet af bor-dopet grafen
- Vand omgiver Mississippi by, mens floder stiger over det sydlige
- Mikroskopets indvirkning på Science


