Undersøgelse viser, at nanopartikler tjener som et godt tumordeoxygeneringsmiddel

Skematisk diagram af MS NP'er, der tjener som en intratumoral DOA til specifik cancer-sultende terapi. Aktiveret af det sure tumormikromiljø, MS NP'erne producerer reaktiv silan for at give anledning til en effektiv deoxygeneringseffekt og producerer in situ SiO2-blokkere i tumorblodkapillærer, som efterfølgende forhindrer uønsket reoxygenering. Den iltfattige tumor uden yderligere ilttilførsel vil kvæles i mangel af det nødvendige energistofskifte. MS NP her er de PVP-modificerede Mg2Si nanopartikler.
(Phys.org) – En målterapi i kræftforskning er at kvæle tumoren. Celler har brug for ilt for at overleve, så forskere har fokuseret på metoder til at afbryde blodtilførslen til tumoren. Meget lidt forskning har involveret direkte fjernelse af ilt i tumoren.
Til denne ende, en gruppe forskere fra Shanghai Institute of Ceramics, Chinese Academy of Sciences og East China Normal University har udviklet et deoxygeneringsmiddel ved hjælp af polyvinylpyrrolidon modificeret Mg 2 Si nanopartikler. Dette middel er pH-følsomt, forbruger effektivt ilt, og et af produkterne fra iltforbrug danner også aggregater, der potentielt kan blokere blodkar. Foreløbige museundersøgelser viser tumorhypoxi og god biokompatibilitet. Deres arbejde vises i Natur nanoteknologi .
Der er flere vigtige egenskaber for et godt tumor-sultende middel. For en, midlet skal være biokompatibelt, hvilket ophæver brugen af tungmetaller til iltabsorption. Derudover midlet skal være effektivt til deoxygenering og fungere som en langsigtet iltfjerner, herunder forebygge re-oxygenering af deoxygenerede tumorer gennem ubeskadigede blodkar. Og, som altid, enhver kræftbehandling skal målrettes mod tumorer uden at beskadige sundt væv, og midlet skal let kunne injiceres med sprøjte.
I den aktuelle forskning, Zhang et al. udviklet polyvinylpyrrolidin (PVP)-modificeret Mg 2 Si nanopartikler, der har flere af egenskaberne for et godt tumor-sultende middel. Vigtigt, hovedkomponenterne, magnesium, siliciumdioxid, og vand er biokompatible. Derudover reaktionsmekanismen danner et meget reaktivt O 2 skurvogn, SiH 4 , som tjener til at gøre disse nanopartikler meget effektive til at opfange ilt.
For at lave injicerbare nanopartikler, Zhang et al. udviklet en selvudbredende højtemperatursyntese i en oxygen-argon-atmosfære. Dette gør det muligt for nanopartiklerne at forblive spredt i væsken, i stedet for at danne klynger, så de kan injiceres i væv. Denne syntese udnytter dannelsen af MgO-biprodukt, der standser den kontinuerlige dannelse af Mg 2 Si aggregater.
En del af reaktionsmekanismen involverer dannelsen af Si 4- , som er meget følsom over for syre. Dette er vigtigt, fordi tumormiljøet har tendens til at være surt sammenlignet med normalt væv (pH~6,4), og pH-følsomhed kan hjælpe med vævsspecificitet. For at undersøge pH-følsomheden af deres deoxygeneringsmiddel, Zhang et al. anbragte deres nanopartikler i en dialysepose, som derefter blev nedsænket i bufferopløsninger med varierende pH-værdier i lukkede rør. Under sure forhold, nanopartiklerne reducerede irreversibelt niveauet af ilt, men var ikke-reaktive i neutral pH. Desuden, SiO 2 aggregater dannet in situ, der tjente til at blokere en simuleret kapillar.
Yderligere undersøgelser viste, at MgSi 2 nanopartikler udviste meget lidt cytotoksicitet, indtil de stødte på det sure miljø i kræftcellen. Brug af MCF-7 humane brystadenokarcinomceller, Zhang et al. observerede, at kombinationen af syre og nanopartikler førte til celleeffektiv hypoxi. Desuden, celleproliferation faldt, hvilket sandsynligvis skyldes mitokondriel skade fra deoxygenering.
In vivo undersøgelser med bilaterale 4T1 xenotumor-bærende mus viste, at Mg 2 Si-nanopartikler tjente som effektive deoxygeneringsmidler. Hver mus blev injiceret med nanopartikel-deoxygeneringsmidlet i højre tumor og med saltvandsopløsning som kontrol i venstre tumor. Målinger af iltmætningsniveauer i blodet efter ti minutter viste ringe ændring i kontroltumoren og en drastisk reduktion af ilt i testtumoren. Iltreduktionen fortsatte i tre timer i den testede tumor, indtil test på både hæmoglobinbundet oxygen og blodilt viste fuldstændig udtømning i tumoren. Især PET/CT-billeder viser, at hypoxi forekom i tumoren og ikke i det omgivende væv.
Yderligere observationer fra in vivo-undersøgelsen viste, at de tumorer, der modtog Mg 2 Si-nanopartikler viste en langsommere væksthastighed sammenlignet med kontroller og efter 24 timer, selvom celleproliferationen ikke blev bremset så signifikant som i in vitro undersøgelserne. Disse celler viste tegn på fibrose, nekrose, og apoptose. Derudover magnesium blev hurtigt fjernet fra kroppen, mens silicium til sidst blev elimineret.
Samlet set, denne forskning giver et overbevisende proof-of-concept for brugen af PVP-modificeret Mg 2 Si nanopartikler som potentielle kandidater til brug som et tumor-målrettet deoxygenerende middel. Forfatterne påpeger, at fremtidig forskning vil involvere at udforske overflademodifikationer af nanopartiklerne for at skræddersy den tid, nanopartiklerne kan rejse gennem blodstrømmen.
© 2017 Phys.org
 Varme artikler
Varme artikler
-
 En mere effektiv måde at gøre saltvand til drikkevandEn ledende metal-organisk ramme (MOF) er en ny type membran til afsaltning af vand. Kredit:Amir Barati Farimani, Carnegie Mellon University Vandmangel er et stort problem i hele verden. Det påvirk
En mere effektiv måde at gøre saltvand til drikkevandEn ledende metal-organisk ramme (MOF) er en ny type membran til afsaltning af vand. Kredit:Amir Barati Farimani, Carnegie Mellon University Vandmangel er et stort problem i hele verden. Det påvirk -
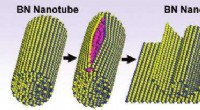 Splitsville for bornitrid nanorørSpaltning af et bornitrid nanorør for at danne et bornitrid nanobånd viser atomer af bor i blåt, nitrogen i gul og kalium i pink. Tryk fra kaliuminterkalation udpakker BNNTen og danner lag af BNNRer.
Splitsville for bornitrid nanorørSpaltning af et bornitrid nanorør for at danne et bornitrid nanobånd viser atomer af bor i blåt, nitrogen i gul og kalium i pink. Tryk fra kaliuminterkalation udpakker BNNTen og danner lag af BNNRer. -
 Fremstilling af en ny generation af memristorer til digital hukommelse og beregningElektronik er kommet langt fra de 200 megabyte, der er gemt på dette 75-pund Memorex 667-diskdrev. Memristorer som den, der er udviklet af Yun Hang Hu, kunne skubbe computeren ind i en ny æra. Mem
Fremstilling af en ny generation af memristorer til digital hukommelse og beregningElektronik er kommet langt fra de 200 megabyte, der er gemt på dette 75-pund Memorex 667-diskdrev. Memristorer som den, der er udviklet af Yun Hang Hu, kunne skubbe computeren ind i en ny æra. Mem -
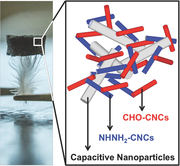 Fra træer til magt:McMaster-ingeniører bygger bedre energilagringsenhedMcMaster Engineering-forskerne Emily Cranston og Igor Zhitomirsky forvandler træer til energilagringsenheder, der er i stand til at drive alt fra et smart ur til en hybridbil. Forskerne bruger cellul
Fra træer til magt:McMaster-ingeniører bygger bedre energilagringsenhedMcMaster Engineering-forskerne Emily Cranston og Igor Zhitomirsky forvandler træer til energilagringsenheder, der er i stand til at drive alt fra et smart ur til en hybridbil. Forskerne bruger cellul


