Immunsystemets forsvarsstyrke fanget i aktion
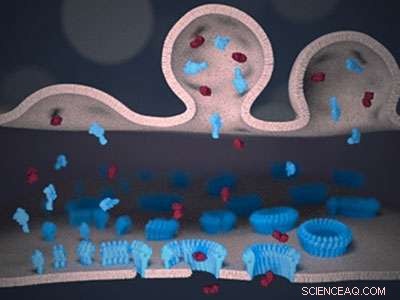
Skematisk visning af immunsynapsen mellem en lymfocyt (øverst) og en målcelle (nederst). Perforin (blå) og granzyme (rød) leveres til synapsen fra lymfocytmembranen (øverst). Perforin binder sig til målmembranen (nederst) og, efter en "voksende pore"-mekanisme, danner transmembrane porer. Porerne tillader de giftige granzymer at passere målmembranen, og udløse celledød. Kredit:Adrian Hodel, UCL
Hvordan den naturlige forsvarskraft i vores immunsystem angriber og ødelægger skadelige angribere såsom virus-inficerede og kræftceller er blevet visualiseret i mikroskopiske detaljer af forskere fra UCL, Birkbeck, University of London, Peter MacCallum Cancer Center og Monash University, Australien.
Forskningen, offentliggjort i dag i Natur nanoteknologi , uddyber forståelsen af den kritiske rolle af proteinet kaldet 'perforin' i et fungerende immunsystem, bringer os et skridt tættere på nye terapier med potentiale til at øge eller hæmme dens virkning, når det er nødvendigt.
Professor Bart Hoogenboom (UCL Physics &Astronomy og London Centre for Nanotechnology) og professor Helen Saibil (Birkbeck, University of London) brugte atomkraftmikroskopi og elektronmikroskopi til at afsløre præcist, hvordan en undergruppe af hvide blodlegemer, kaldet cytotoksiske lymfocytter (eller Killer T-celler), viser bemærkelsesværdig effektivitet ved først at perforere deres ofre og derefter injicere giftige enzymer for at befri kroppen for sygdom.
Ved at bruge en form for mikroskopisk CCTV, det blev vist, hvordan perforin binder sig til den beskyttende membran, der omgiver skadelige celler. Professor Hoogenboom sagde:"Vores immunsystem skal bore huller i virusinficerede og kræftceller for at slippe af med dem, men kan ikke købe sådanne bor i et byggemarked. Vi har nu vist, hvordan den selv samler disse bor på stedet ved at sætte flere perforinmolekyler sammen i ringlignende strukturer, efterlader bittesmå huller - kun snesevis af nanometer i diameter."
lektor Ilia Voskoboinik, en ledende medforfatter (Peter MacCallum Cancer Center), sagde:"At dræbe virus-inficerede eller kræftceller, perforin skal være hurtig og effektiv. Vores eksperimenter i Melbourne viser, at patienter, der er født med svækket perforin, kan have fatalt svigt af immunsystemet og også have en højere risiko for at udvikle blodkræft.
"Dette var helt i overensstemmelse med de mikroskopiske data opnået i London, hvilket viser, at effektiviteten af perforin er stærkt hæmmet, selvom kun et lille antal af perforinmolekylerne er unormale. Denne nye forståelse bringer os et skridt tættere på målrettede terapier, der kan styrke kroppens perforin-producerende kraft til at afværge sygdom. Vi kunne også hæmme dets funktion for at forhindre afvisning af organtransplantationer, når man accepterer fremmed væv eller celler, kan det i stedet være livreddende."
At filme optræde i aktion, forskerne brugte atomkraftmikroskopi i professor Hoogenbooms laboratorium ved London Centre for Nanotechnology ved UCL. Denne type mikroskopi bruger en ultrafin nål til at føle i stedet for at se perforin på en målmembran, ligner en blind person, der læser blindeskrift. Nålen scanner gentagne gange overfladen for at producere et billede, der opdateres hurtigt nok til at spore, hvordan perforinmolekyler samles og skærer huller i membranen.
I første omgang, perforin optrådte som en sløring på disse billeder. Imidlertid, når et par perforinmolekyler sammen indsættes i membranen, de kunne identificeres tydeligere og påvises at rekruttere mere perforin til således at vokse transmembrane porer.
Ved også at optage statiske snapshots i højere opløsning ved hjælp af elektronmikroskopi, Det lykkedes professor Saibils team at estimere, for hver perforin samling, antallet af molekyler på hvert trin af processen. Dette bekræftede en ændring fra løst pakkede små perforinsamlinger på membranen til større og tættere bundne transmembranporer.
 Varme artikler
Varme artikler
-
 Genetisk tilgang hjælper med at designe bredbåndsmetamateriale(l) Dette er en tegning af metamaterialets absorbermønster. (r) Dette er et faktisk metamaterialeabsorbermønster. Kredit:Bossard, Penn State Et specielt formet materiale, der kan levere tilpasset
Genetisk tilgang hjælper med at designe bredbåndsmetamateriale(l) Dette er en tegning af metamaterialets absorbermønster. (r) Dette er et faktisk metamaterialeabsorbermønster. Kredit:Bossard, Penn State Et specielt formet materiale, der kan levere tilpasset -
 Et skridt til solcelleeffektivitet:Forskeres kemiske proces kan forbedre fremstillingenRice University-forskere har reduceret processen til at omdanne siliciumwafers til det sorte silicium, der bruges i solceller, til et trin. Forskuddet kan reducere omkostningerne forbundet med produkt
Et skridt til solcelleeffektivitet:Forskeres kemiske proces kan forbedre fremstillingenRice University-forskere har reduceret processen til at omdanne siliciumwafers til det sorte silicium, der bruges i solceller, til et trin. Forskuddet kan reducere omkostningerne forbundet med produkt -
 2-D nitrogenerede krystaller ny potentiel rival til grafenFigur 1. Fotografier af nøgleforfattere:(til venstre) den første forfatter Javeed Mahmood; (til højre) den korresponderende hovedforfatter Jong-Beom Baek. Copyright:Ulsan National Institute of Science
2-D nitrogenerede krystaller ny potentiel rival til grafenFigur 1. Fotografier af nøgleforfattere:(til venstre) den første forfatter Javeed Mahmood; (til højre) den korresponderende hovedforfatter Jong-Beom Baek. Copyright:Ulsan National Institute of Science -
 Mikroskopiske metabiler drevet af intet andet end lysUfokuseret lys kan bruges til at manøvrere mikroskopiske partikler, belagt med en metasflade, på en kontrolleret måde. De bittesmå partikler kan endda bruges til at transportere andre genstande. Kredi
Mikroskopiske metabiler drevet af intet andet end lysUfokuseret lys kan bruges til at manøvrere mikroskopiske partikler, belagt med en metasflade, på en kontrolleret måde. De bittesmå partikler kan endda bruges til at transportere andre genstande. Kredi


