Nanocages for guldpartikler - Hvad sker der indeni?
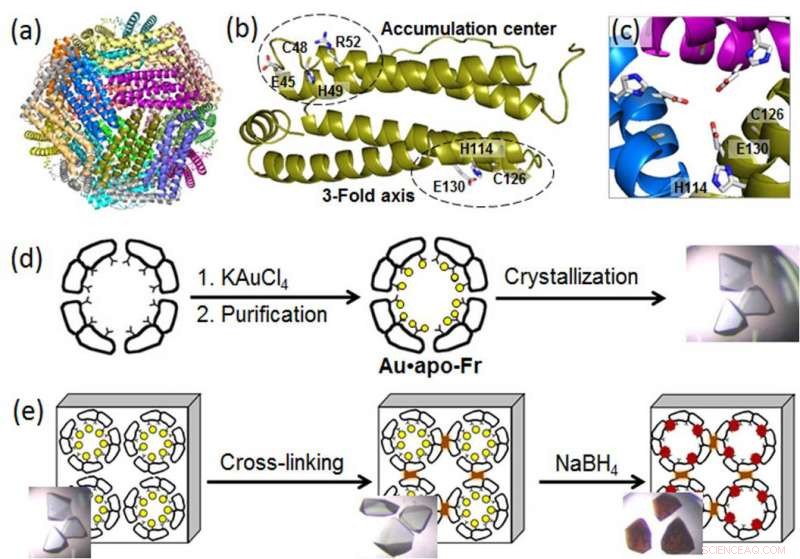
(a) Struktur af 24-mer ferritinmolekylet; (b) en ferritinmonomer med metalbindingsstederne; (c) en symmetrisk 3-fold akse kanal; (d) fremstilling og krystallisation af Au-holdigt ferritin; (e) tværbinding af ferritinkrystallen og reduktion af Au-ioner (gule cirkler) til Au(0)-atomer, som danner nanoclusters (brune partikler). Kredit:Tokyo Institute of Technology
Forskere ved Tokyo Institute of Technology har brugt højopløsningskrystallografi til at afdække mekanismen bag protein-assisteret syntese af guld nanopartikler, at give en platform til at designe nanomaterialer skræddersyet til biomedicinsk anvendelse.
I levende organismer, frie metalioner lagres og transporteres gennem proteiner samlet i højt ordnede strukturer såsom proteinbure via en reaktion kaldet biomineralisering. Denne sofistikerede biologiske strategi har tiltrukket sig opmærksomhed fra bioteknologer, der spekulerer i, at naturlige ion-lagringsproteinbure kan bruges til at dyrke metalnanopartikler med ønskede egenskaber.
Guld nanopartikler (AuNP'er) er kendt for deres fremragende funktioner i katalyse, bioimaging, medicin levering, og terapi; derfor, syntesen af AuP'er med kontrollerede størrelser og former er meget vigtig for deres anvendelse i nanomedicin. I proteinstilladser, AuNP'er dannes af en sekventiel proces, der involverer guldaflejring og agglomeration i små nanoclusters, der fungerer som nukleationscentre for AuNP-vækst. Imidlertid, den dynamiske mekanisme, der ligger til grund for dannelsen af guld-nanoklynger i proteinmiljøer, er stadig uklar.
For at afsløre molekylære processer bag AuNP-vækst i protein-nanocages, en gruppe biomolekylære ingeniører ved Tokyo Institute of Technology, ledet af Takafumi Ueno, brugt højopløsningskrystallografi og analyseret dannelsen af guldnanoclusters i ferritin. Et universelt intracellulært jernlagerprotein produceret af næsten alle levende organismer, ferritin danner en selvsamlet 24-underenhed nanocage med to specifikke metalbindingssteder:den 3-foldede akse kanal og akkumuleringscentret (figur). Da guldioner har høj affinitet til svovl, forskerne modificerede akkumuleringscentret ved at indføre en yderligere svovlholdig cysteinrest for at øge guldoptagelsen i proteinburet. Derefter, de forstærkede Au-holdige ferritinkrystaller ved at tværbinde i glutaraldehyd (figur) for at bevare deres gitterstruktur. Disse modifikationer muliggjorde reduktion af guldioner i krystallerne og bestemmelse af bindingspositioner af guldioner inde i ferritinburet ved højopløsningskrystallografi.
I næste trin, de immobiliserede guldioner blev reduceret til Au(0)-atomer under anvendelse af et reduktionsmiddel (NaBH4). Som resultat, forskerne kunne observere, at det reducerede guld agglomererede til nanoklynger dannet i de 3-fold symmetriske kanaler og i metalakkumuleringscentrene, hvilket skyldtes den gradvise guldbevægelse og konformationsændringer af omgivende aminosyrer.
Resultaterne opnået af professor Ueno og hans kolleger afslører mekanismen bag dannelsen af guld nanoclusters, som forventes som nukleationscentre for efterfølgende AuNP-vækst i det unikke proteinmiljø, at give en platform for fremtidig undersøgelse af biomineralisering og nanopartikelsyntese i biomolekylære stilladser.
 Varme artikler
Varme artikler
-
 Forskere finder måder at forbedre sæbe og vand påKredit:Runze Huang, Nachiket Vaze, Anand Soorneedi, Matthew D. Moore, Yalong Xue, Dhimiter Bello, Philip Demokritou Nanosikkerhedsforskere ved Harvard T.H. Chan School of Public Health har udvikle
Forskere finder måder at forbedre sæbe og vand påKredit:Runze Huang, Nachiket Vaze, Anand Soorneedi, Matthew D. Moore, Yalong Xue, Dhimiter Bello, Philip Demokritou Nanosikkerhedsforskere ved Harvard T.H. Chan School of Public Health har udvikle -
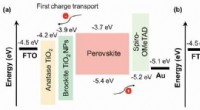 Lagdeling af titaniumoxider forskellige mineralske former for bedre solcellerSkematisk illustration af energiniveaujusteringen mellem enhedskomponenterne med (a) FTO-AB og (b) FTO-BA som ETLer. Kredit:Kanazawa University Forskere har lagt forskellige mineralske former for
Lagdeling af titaniumoxider forskellige mineralske former for bedre solcellerSkematisk illustration af energiniveaujusteringen mellem enhedskomponenterne med (a) FTO-AB og (b) FTO-BA som ETLer. Kredit:Kanazawa University Forskere har lagt forskellige mineralske former for -
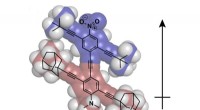 Forskere arbejder på næste generations nanobilerRice University vil rulle op til det andet internationale Nanocar Race med et nyt køretøj. Bilen med et molekyle har en permanent dipol, der gør den nemmere at styre. Kredit:Alexis van Venrooy/Rice Un
Forskere arbejder på næste generations nanobilerRice University vil rulle op til det andet internationale Nanocar Race med et nyt køretøj. Bilen med et molekyle har en permanent dipol, der gør den nemmere at styre. Kredit:Alexis van Venrooy/Rice Un -
 Kunstig nanoporeproduktion kan føre til tidlig påvisning af sygdomEt Atomic Force Microscope-billede af en 100 nm nanopore i silicium. Grøn er det molekyle af interesse i prøven, der vil blive kørt gennem nanoporen i laboratoriet. (Phys.org) -- Et multidisciplin
Kunstig nanoporeproduktion kan føre til tidlig påvisning af sygdomEt Atomic Force Microscope-billede af en 100 nm nanopore i silicium. Grøn er det molekyle af interesse i prøven, der vil blive kørt gennem nanoporen i laboratoriet. (Phys.org) -- Et multidisciplin
- Blue Origin opsender kapsel til rummet med astronautfrynsegoder
- Forskere trækker sig tilbage mod Harvards rumfartøjsteori
- Fangelys, der ikke hopper af sporet for hurtigere elektronik
- Hong Kong Airlines vil afskedige 400 medarbejdere, da virus rammer byen
- En bedre kulstoffælde vil tage drivhusgasser ud af luften og tage dem i brug
- Hvordan kan jeg huske Math Properties?


