Din hjerne på mesh:Injicerbar fleksibel sonde smelter sammen med neuroner, forårsager lidt eller ingen kronisk immunrespons
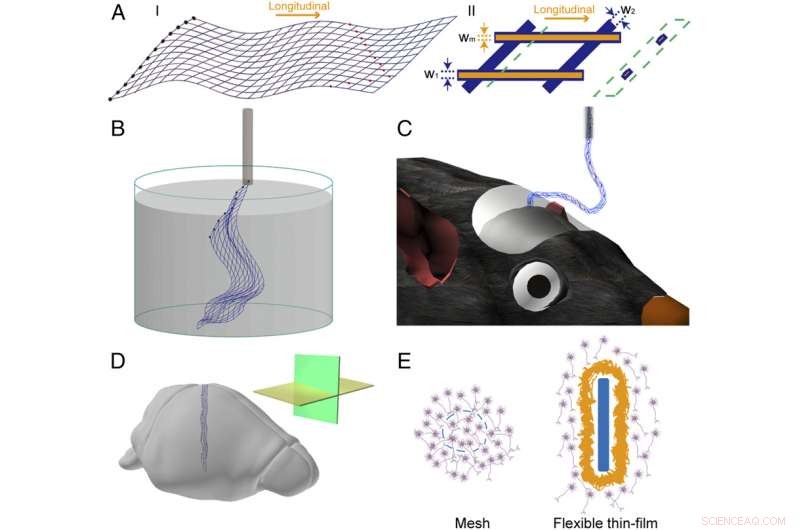
Fig. 1. Skema af mesh elektronik. ( EN ) Skema af mesh-elektronikstrukturen i 2D. ( jeg ) Overordnet design af mesh elektronik struktur, hvor de blå linjer fremhæver den overordnede maskestruktur, de sorte udfyldte cirkler til venstre indikerer I/O-puder, og de røde udfyldte cirkler indikerer optagelseselektroder. ( II ) En enkelt enhedscelle af mesh-elektronik, hvor de orange linjer, som er vist uden øverste polymerlag, fremhæve metalforbindelserne og blå linjer svarer til polymerpassiveringslaget; w 1 , w 2 , og w m angive bredden af den langsgående polymer, tværgående polymer, og metallinjer, henholdsvis. Skemaet i den grønne stiplede boks fremhæver tværsnitsvisningen, som viser den polymerindkapslede metalstruktur, på den position, der er angivet med den grønne stiplede linje. ( B ) Skematisk af fritstående mesh-elektronik, der flyder i vandig opløsning og klar til at blive fyldt i en glasnål. ( C ) Skematisk mesh-elektronik indsprøjtet i musens hjerne, med en del af nettet hængende mellem hjernen og nålen. ( D ) Skematisk mesh-elektronik implanteret i hjernevæv med vandret (gult plan) og sagittalt (grønt plan) snitretninger fremhævet i indsætningen. ( E ) Skematik af grænsefladen mellem meshelektronik og hjernevævet ( Venstre , tværsnit) og det mellem fleksibel tyndfilm og hjernevævet ( Ret , tværsnit). Mesh-elementer og den fleksible tynde film er fremhævet i blåt, neuroner er i lilla, og glialarret er i gult. Kredit:Zhou T, Hong G, Fu TM, Yang X, Schuhmann TG, Robert D. Viveros, RD, Lieber CM (2017) Sprøjte-injicerbar mesh-elektronik integreres problemfrit med minimalt kronisk immunrespons i hjernen. Proc Natl Acad Sci USA 114(23):5894-5899.
(Phys.org)—Neuroproteser, neurale prober og andre intraneurale vævsimplantater har tilbudt bemærkelsesværdige fordele for modtagere på en række områder inden for neurovidenskabelig forskning og biomedicinske applikationer, terapeutiske eksempler er ikke kun Alzheimers sygdom, Parkinsons sygdom, epilepsi, traumatisk hjerneskade, og andre neurologiske/neurologisk relaterede tilstande, samt kognition, hukommelse, og sansemotoriske lidelser. Imidlertid, nuværende neurale implantater har flere ulemper, inklusive inflammation af neuralt væv eller ardannelse på grund af mikrobevægelse af enheden, samt lang levetid og det potentielle behov for fjernelse, og høje strømkrav. Det har derfor været et eftertragtet mål at udtænke elektriske prober, der sømløst integreres i neuralt væv. Til det formål, forskere ved Harvard University har rapporteret om den vellykkede implantation af en neuromorf (dvs. med en struktur svarende til hjernevæv) ultrafleksibel åben mesh elektronik neural probe, der leveres til specifikke hjerneregioner via sprøjteinjektion (en protokol, de udgav i 2015 i Natur nanoteknologi ) 1 .
Sonden - som ikke kræver strømforsyning - registrerer ændringer i neurale spændinger direkte ved at kunne kommunikere med alle områder af hjernen fra niveauet af enkelt neuron gennem kredsløb og netværk, hvor netoptagelseselektroden er forbundet med passiverede metallinjer (dvs. med en beskyttende belægning påført overfladen) på input/output puder placeret i den modsatte ende af maskestrukturen. Disse I/O pads, på tur, forbindes derefter til Flat Flexible Cables (FFC) og tilsluttes eksternt system til optagelse. Forskerne udførte også systematiske post-implantationsundersøgelser, finde minimale eller fraværende neurale immunresponser, og desuden at hjernevæv var trængt ind og smeltet sammen med mesh-sonden. Forskerne bemærker, at mesh-implantatet måske aldrig skal fjernes - men hvis det gør det, at gøre det ville være en ligetil, hvis ikke problemfri procedure. De konkluderer, at de fleste områder inden for fundamental neurovidenskabelig forskning kan have gavn af meshelektronik, der giver langsigtet stabilitet og single-neuronopløsning-unikke egenskaber, der ikke findes i konventionel neuroprostetik-og angiver i deres papir, at ultrafleksible elektroniske elektroniske sonder i fremtiden i fremtiden kan muliggøre en bred vifte af muligheder for in vivo kronisk registrering og modulering af hjerneaktivitet.
Kemisk biologi Mark Hyman Jr. Professor i kemi Charles Lieber diskuterede papiret, at han, Hovedforfatter Graduate Student Tao Zhou, Postdoktor Guosong Hong, og deres kolleger udgivet i Proceedings of the National Academy of Sciences . "Hovedudfordringen ved at designe og implantere en injicerbar ultraflexibel open mesh -probe er at sikre, at designet har fire nøglefunktioner, ", fortæller Lieber Phys.org . Disse faktorer er maskeåbninger større end cellelegemer for at lette neuronpenetration; maskeelementfunktioner, der er af samme størrelse eller mindre end neuroner; fleksibilitet, der i denne undersøgelse var mange størrelsesordener større end neuronernes; og mesh-elektronik, der nemt kan sprøjtes ind gennem meget høje nåle for præcist at kontrollere mesh-positionen. "Ved at designe mesh-elektronikken sådan, at alle nøgleegenskaber neuromorfisk ligner neuralt væv, vi eliminerer kronisk immunrespons, der findes med alle andre prober og medicinske implantater, som er mere som torne i dit væv."
Som nævnt tidligere, forskernes papir fra 2015 initierede konceptet med sprøjteinjicerbar elektronik, som Lieber bemærker, åbner op for et nyt felt med mange muligheder, der afventer yderligere undersøgelser - et eksempel er co-injektion af elektronik og celler, hvor mesh-elektronik også fungerer som et vævsvækststillads, der er relevant for regenerativ medicin. "I papiret, der diskuteres heri, rapporterer vi systematiske tidsafhængige kroniske histologiske undersøgelser af væv-mesh-grænsefladen, efter at mesh-proberne blev implanteret i gnaverhjerner. Både vandret (som indeholder tværsnit af implanterede mesh-prober) og sagittalt (som indeholder næsten hele de implanterede mesh-prober) hjerneskiver blev brugt til immunhistokemi og blev farvet med antistoffer, der kan målrette mod neuron somata, axoner, astrocytter og mikroglia. Resultaterne i denne artikel afslører det unikke ved mesh-prober med hensyn til minimal eller fravær af vævsrespons og neuronpenetration, når de implanteres kronisk i hjernen.
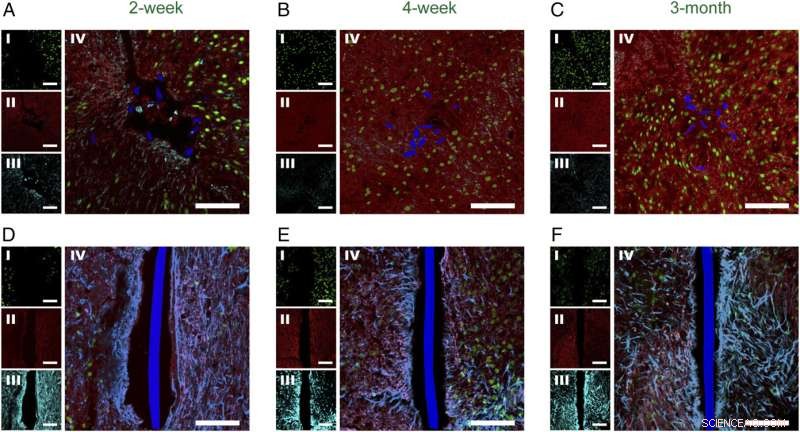
Fig. 2. Tidsafhængig histologi af horisontale vævsskiver indeholdende implanteret mesh-elektronik og fleksible tyndfilmsonder. Konfokale fluorescensmikroskopibilleder af horisontale vævsskiver indeholdende mesh-elektronik/fleksible tyndfilmsonder ved 2 uger ( EN og D ), 4 uger ( B og E ), og 3 mdr. ( C og F ) postimplantation. I alle panelerne var billedetiketterne NeuN ( jeg , grøn), NF ( II , rød), GFAP ( III , cyan), og NeuN, NF, GFAP-komposit ( IV ). Mesh-elektronikken og fleksible tyndfilmstværsnit er pseudofarvet blå. (Skalabjælker i alle billeder, 100 μm.) Kredit:Zhou T, Hong G, Fu TM, Yang X, Schuhmann TG, Robert D. Viveros, RD, Lieber CM (2017) Sprøjte-injicerbar mesh-elektronik integreres problemfrit med minimalt kronisk immunrespons i hjernen. Proc Natl Acad Sci USA 114(23):5894-5899.
Forskerne brugte standardfotolitografi til at fremstille mesh-elektronikproberne ved hjælp af en polyimid-baseret fotoresist (polyimider er biokompatible) i en trelagsstruktur;
1. den nederste maskestruktur (typisk ~400 nm tyk) er defineret i henhold til det specifikke design
2. metalforbindelserne, input/output pads, og hjerneelektroder er defineret, disse er ~100 nm tykke
3. det øverste lag af polyimidresist er defineret således, at alt metal er indkapslet undtagen I/O-puderne og elektroderne, hvor tilgangen og efterfølgende polymerbehandling fører til en robust nær-monolitisk struktur <1 um i tykkelse
Lieber påpeger, at den neuromorfe karakter af meshelektronikproberne er relateret til ovenstående tre punkter, den bio/neurale kompatibilitet af polyimidpolymeren, der bruges til masken, og postimplantationen åben tredimensionel meshstruktur. Sammen, tilføjer han, disse funktioner gør den injicerede mesh-elektronik ret lig neurale netværk, der omfatter hjernevæv, og derfor helt adskilt fra konventionelle sonder.
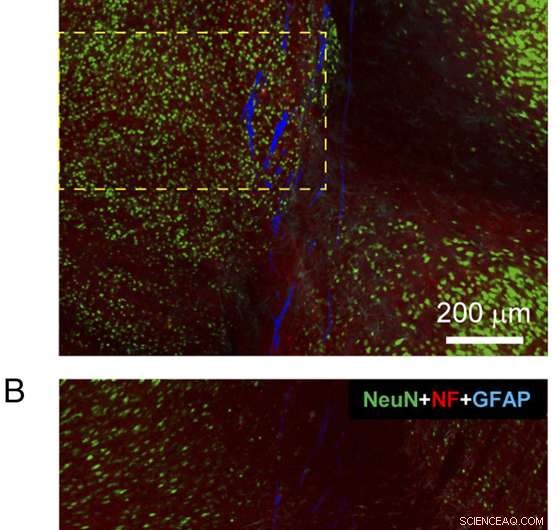
Fig. 4. Histologi af en sagittal vævsskive, der indeholder næsten hele den implanterede mesh-elektroniksonde. ( EN og B ) Konfokale fluorescensmikroskopibilleder af en sagittal vævsskive inklusive mesh-elektroniksonden ved 3 måneders postimplantation. Hvert af billederne er 3×3 sammensatte billeder optaget direkte i Tile Scan-tilstand, hvor hvert komponentbillede af Tile Scan havde et synsfelt på 425 μm × 425 μm. Vævsskiven blev farvet med antistoffer for NeuN (grøn), NF (rød), og GFAP (cyan); nettet er vist som pseudofarvet blåt. Billederne blev optaget i et optisk brændplan ca. 5 μm under overfladerne af side-A ( EN ) og side-B ( B ). ( C ) Fluorescensintensitet som funktion af afstanden fra grænsen af mesh-elektronikken i billeder af side-A ( EN ) og side-B ( B ). De lyserøde skraverede områder angiver det indre af meshelektronik på hver side. NF- og GFAP-fluorescensintensiteten blev analyseret baseret på hele billederne, og NeuN-fluorescensintensiteten blev analyseret baseret på regionerne vist i gule stiplede felter i EN og B . Fejlbjælker repræsenterer SEM. Kredit:Zhou T, Hong G, Fu TM, Yang X, Schuhmann TG, Robert D. Viveros, RD, Lieber CM (2017) Sprøjte-injicerbar mesh-elektronik integreres problemfrit med minimalt kronisk immunrespons i hjernen. Proc Natl Acad Sci USA 114(23):5894-5899.
"De vigtigste udfordringer ved at demonstrere, at proberne ikke fremkalder betændelse eller ardannelse - i modsætning til den typiske kroniske vævsrespons - er at karakterisere væv-mesh-grænsefladen på forskellige tidspunkter efter implantation, " forklarer Lieber. For at opnå dette, uden at fjerne implanterede mesh-prober sektionerede forskerne musehjerner i både tværsnits- og langsgående eller sagittale (venstre/højre) skiver. "Undersøgelser af både tvær- og længdesnit med den implanterede mesh-elektroniksonde gav detaljerede og globale visninger, henholdsvis, af sonde/væv interaktion, " bemærker han, understreger, at konventionelle prober i de fleste tilfælde skal fjernes fra væv før sektionering, hvilket resulterer i tab af nogle vigtige grænsefladeoplysninger.
"De vandrette og sagittale hjerneskiver - som indeholder tværsnit af implanterede mesh-prober, og næsten hele den implanterede mesh-sonde, henholdsvis - blev farvet med antistoffer, der kan målrette neuron somata, axoner, astrocytter og mikroglia, "Liber fortsætter, I øvrigt, han påpeger, at disse undersøgelser viste, at i modsætning til konventionelle sonder, neuron somata og axoner omkring mesh-prober blev ikke beskadiget, og førte til naturlige vævsniveauer ved maskesondens overflade. "På samme måde markørerne for immunrespons inflammation, der fremhæver astrocytter og mikroglia, viste, at disse arter blev baggrundsniveauer efter kun et par uger i mesh-elektronikken - men de prolifererede og akkumulerede ved grænsefladerne mellem konventionelle sonder." Forskerne fandt også, at evnen til at tillade neuronerne og nettet til at trænge ind i hinanden er universelt for alle masker, de injicerede og afbildede 6 ~ 12 uger efter injektion, tilskynde dem til at igangsætte yderligere eksperimenter for at finde ud af, hvordan størrelsen af mesh elektronik strukturelle elementer og andre parametre kan justeres for at forbedre evnen til neuroninterpenetration.
Det bør noteres, Lieber fortæller Phys.org , at forskerne er konservative, når de i deres papir skriver et minimalt immunrespons i afventning af mere detaljerede markøranalyser. "Faktisk, vi mener, at der ikke er noget immunrespons fra nettet, fordi vores resultater viser, at enhver indledende forbedring af astrocytter og mikroglia vender tilbage til baggrunden uden nogen målbar forskel nær eller distalt for sonden efter 12 uger – og, som vist i vores 2016 Naturmetoder papir 1 - op til mindst et år. Vi mener således, at responsen skyldes akut skade, der opstår ved indføring af nålen (eller for den sags skyld, enhver probe) ind i hjernen - men i betragtning af manglen på immunrespons fra mesh-sonden, denne akutte skade heler over tid, i modsætning til forværring, som det er tilfældet med konventionelle sonder."
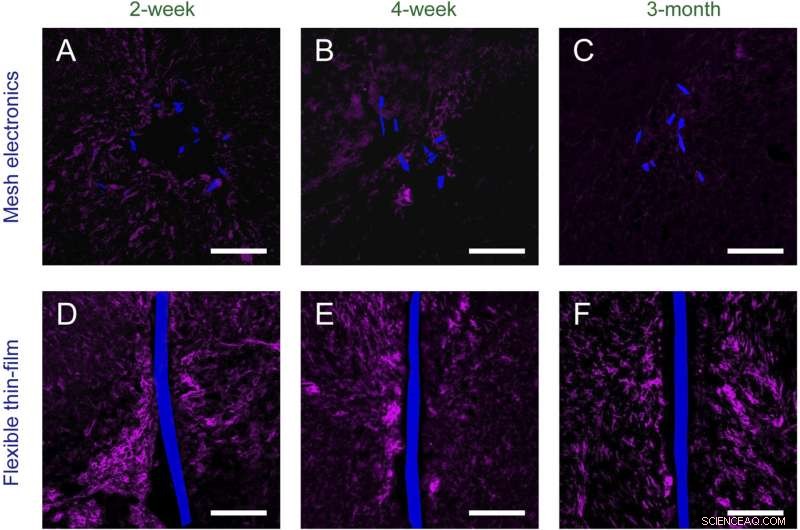
Fig. S2. Tidsafhængig histologi af kronisk implanteret mesh-elektronik ( EN – C ) og fleksible tyndfilmsprober ( D – F ) i musehjerner (vandrette snit). Vævsskiver er mærket med Iba-1 (magenta) for at fremhæve mikroglia; meshelektronik og fleksible tyndfilmsprober blev afbildet af DIC og er pseudokoloreret blå. (Skalaer i alle billeder, 100 μm.) Kredit:Zhou T, Hong G, Fu TM, Yang X, Schuhmann TG, Robert D. Viveros, RD, Lieber CM (2017) Sprøjte-injicerbar mesh-elektronik integreres problemfrit med minimal kronisk immunrespons i hjernen. Proc Natl Acad Sci USA 114(23):5894-5899.
Den minimale, genoprettelig akut skade og fraværet af et immunrespons understøtter muligheden for, at mesh-elektronik kan være permanent levedygtig. "Ifølge vores tidligere og igangværende undersøgelser hidtil, mesh-prober kan opretholde en stabil registrerings-/stimuleringsgrænseflade med hjernevævet i mindst et til to år, "Siger Lieber." Dog, denne tidsperiode repræsenterer ikke den opnåelige forventede levetid, da igangværende undersøgelser i øjeblikket er undervejs for at demonstrere endnu længerevarende stabilitet." På grund af begrænsningen af gnaverens to- til treårige levetid, forskerne forventer at finde mere omfattende stabilitet i længerelevende pattedyr såsom rhesus macaques og i undersøgelser, der i øjeblikket er i gang. "I tilfældet med fraværende immunrespons som vist i vores nylige papir, den forventede levetid for mesh-elektronik bør kun bestemmes af materialernes biokompatibilitet og levetid, inklusive metalelektroderne (guld og platin, som begge er inerte), og den passiverende polymer, der er blevet grundigt undersøgt i tidligere publikationer (såsom Nemani et al 2 ) for at vise langtidsstabilitet under fysiologiske forhold). Derfor, vi forbliver sikre på, at mesh-elektronik sandsynligvis vil have en forventet levetid med stabil neural grænseflade og optage-/stimuleringsfunktioner i årevis, og forestiller sig masken i sidste ende som livstidsimplantat."
Imidlertid, Lieber tilføjer, hvis nettet skal fjernes, det kan ekstraheres direkte med minimal kraft og skade på hjernen. "Selvom dette kan forårsage en lille mængde skade på grund af sømløs integration med neuralt væv, Vi tror, at den hidtil usete stabilitet og fraværet af kronisk immunrespons i vores neurale vævslignende mesh-elektronik vil føre til et paradigmeskifte, hvor sonden er en livslang implantation, der ikke kræver fjernelse."
Bevæger sig fremad, Lieber siger, at de udfører løbende undersøgelser af nye mesh-designs med et stort antal elektroder og multisite-injektioner. "I øvrigt, vores næste trin omfatter implantationer af mesh-elektronik i andre væv og organer end hjernen – f.eks. i øjet for in vivo registrering af enkelte retinale ganglieceller, i rygmarven, i musklen for at studere signaludbredelse ved det neuromuskulære kryds, og så videre. Vi begynder også undersøgelser, der udnytter den hidtil usete stabilitet og fraværet af kronisk immunrespons af mesh-elektronikken i Alzheimers og Parkinsons sygdomsmodeller, og arbejder på implantation af meshelektronik i ikke-menneskelige primater og mennesker. "
De ser også en bred vifte af nuværende og potentielle applikationer, der drager fordel af brugen af deres mesh-sonde, inklusive rygmarvs- og neuromuskulære overgangsimplantater, hjerne-maskine grænseflader, cyborg dyr, naturlig og patologisk aldring (såsom Alzheimers sygdom) med indsigt i, hvordan rumlig hukommelse og indlæring udvikler sig som funktion af alder og sygdomsstadium. I øvrigt, ved at tilføje stimuleringselektroder, at være i stand til at muliggøre feedback på fint niveau, der kan forbedre eller overvinde de kognitive fald i forbindelse med aldring og andre neurodegenerative sygdomme.
Med hensyn til andre forskningsområder, der kunne drage fordel af deres undersøgelse, Lieber siger, at generelt, de fleste områder af fundamental neurovidenskabsforskning kunne drage fordel af mesh-elektronikkens unikke egenskaber med langsigtet stabilitet og enkeltneuronopløsning. "Ud over, almost any clinical/medical application that involves electrical recordings and/or stimulations will benefit from our studies. In addition to that mentioned above, " konkluderer han, "the mesh electronics should provide unique opportunities for brain-machine interfaces for tetraplegic patients, deep brain stimulations for the treatment of Parkinson's disease, and neural prosthetics in general."
© 2017 Phys.org
Sidste artikelTredimensionel chip kombinerer databehandling og datalagring
Næste artikelBelyser vejen til optimal fotokatalyse
 Varme artikler
Varme artikler
-
 Meget følsom nanosensor registrerer subtile kaliumændringer i hjernenDesign og sensormekanisme for K+ nanosensoren. (A) Skematisk illustration til syntesen af nanosensoren. NaYF4:Yb/Tm@NaYF4:Yb/Nd (UCNP) -kernen blev syntetiseret og overtrukket med et tæt silicagelag
Meget følsom nanosensor registrerer subtile kaliumændringer i hjernenDesign og sensormekanisme for K+ nanosensoren. (A) Skematisk illustration til syntesen af nanosensoren. NaYF4:Yb/Tm@NaYF4:Yb/Nd (UCNP) -kernen blev syntetiseret og overtrukket med et tæt silicagelag -
 2D nanomateriale MXene:Det perfekte smøremiddel til rovereAtomlagene kan bevæge sig i forhold til hinanden, reducere friktion. Kredit:Vienna University of Technology Du kan smøre en cykelkæde med olie, men hvad gør man med en Mars-rover eller et rødgløde
2D nanomateriale MXene:Det perfekte smøremiddel til rovereAtomlagene kan bevæge sig i forhold til hinanden, reducere friktion. Kredit:Vienna University of Technology Du kan smøre en cykelkæde med olie, men hvad gør man med en Mars-rover eller et rødgløde -
 Lille størrelse - stort potentialeSmå fibre eller stænger af titaniumoxid, der stammer fra den manganoxidbaserede skabelon. Foto leveret af College of Liberal Arts and Sciences (PhysOrg.com) - En kemiprofessors nanoteknologiforskn
Lille størrelse - stort potentialeSmå fibre eller stænger af titaniumoxid, der stammer fra den manganoxidbaserede skabelon. Foto leveret af College of Liberal Arts and Sciences (PhysOrg.com) - En kemiprofessors nanoteknologiforskn -
 Forskere udpeger årsagen til skadelige dendritter og knurhår i lithiumbatterierPNNL videnskabsmænd Chongmin Wang, Wu Xu og Yang He med det specielt modificerede miljøtransmissionselektronmikroskop, de brugte til at optage billeder og video af voksende knurhår inde i et lithiumba
Forskere udpeger årsagen til skadelige dendritter og knurhår i lithiumbatterierPNNL videnskabsmænd Chongmin Wang, Wu Xu og Yang He med det specielt modificerede miljøtransmissionselektronmikroskop, de brugte til at optage billeder og video af voksende knurhår inde i et lithiumba
- Robotter kan overliste os på den virtuelle slagmark, så lad os ikke sætte dem til at styre den æ…
- Mod praktiske kvantecomputere:Indbygget optik kunne muliggøre chips, der bruger fangede ioner som k…
- Observationer undersøger den neutrino-udsendende blazar TXS 0506+056
- Carbon nanorør-enhed kanaliserer varme til lys
- DET sker:Facebook beklager Xi Jinpings navnefalske
- Hvad er fire ikke-levende ting i et ørkenøkosystem?


