Cellepenetrerende nanobor viser løfte om intracellulær lægemiddellevering
Forskere ved Oregon State University og Oregon Health &Science University har skabt nye nanomaterialer, der kan krydse cellemembraner, etablering af en ny platform til intracellulær levering af molekylære lægemidler og anden last.
Forskerne undersøgte, hvordan man justerer størrelsen, form og morfologi af materialer kendt som cellegennemtrængende selvsamlende peptidnanomaterialer, eller CSPN'er.
De brugte sekventiel ligering af peptidbyggesten til at skabe CSPN'er, der dannede forskellige former, der lignede en borekrone, og disse "nanodriller" viste en stærk kapacitet til at indkapsle gæstemolekyler til terapi eller billeddannelse.
Resultater blev offentliggjort i Journal of Controlled Release , og en foreløbig patentansøgning er blevet indgivet til U.S. Patent and Trademark Office.
"CSPN'er repræsenterer en ny modulær lægemiddelleveringsplatform, der kan programmeres til udsøgte strukturer gennem sekvensspecifik finjustering af aminosyrer, " sagde den tilsvarende forfatter Gaurav Sahay, assisterende professor i farmaceutiske videnskaber ved OSU/OHSU College of Pharmacy. "Finjusteringen af aminosyrer bidrog med alsidige egenskaber som fleksibilitet, selvmontering, højere medicinbelastning, bionedbrydelighed og biokompatibilitet til effektiv intracellulær levering af CSPN'er."
Sahay laboratorieteamet og samarbejdspartnere, herunder forskere fra OHSU School of Medicine og University of California San Diego, genererede fem forskellige CSPN'er, konjugering af Tat-peptider til en (RADA)2-linker og tilføjelse af forskellige antal phenylalaninrester.
"Vi valgte (RADA)2, fordi det indeholder alternerende aminosyrer, der afviser vand og blandes med vand; det bidrog til egenskaben til selvsamling, " sagde første forfatter Ashwani Narayana, postdoc ved Farmaceutiske Højskole. "Vi demonstrerede overgangen af sekundær struktur i disse CSPN'er, som igen spillede en afgørende rolle i selvsamling og potentiale for lægemiddellevering. In vivo-effektiviteten af disse nanodriller vil udvide grænserne ud over intracellulær levering."
CSPN'er med to, tre eller fire phenylalaninrester selvsamlet til nanobor, der viser en groft snoet, ikke-snoet eller fin-snoet morfologi, henholdsvis.
"Disse nanobor havde en høj kapacitet til at indkapsle hydrofobe gæstemolekyler, "Narayana sagde. "Specielt de groft snoede nanobor demonstrerede højere internalisering og var i stand til at lokalisere rapamycin i leveren i en musemodel."
Rapamycin er en antifungal metabolit af Streptomyces hygroscopicus bakterien og blandt dens mange egenskaber er evnen til at fremkalde autofagi – den regulerede, velordnet nedbrydning og genbrug af cellulære komponenter.
"Defekter i autofagi fører til ophobning af giftige materialer under forskellige sygdomstilstande lige fra infektionssygdomme til neurodegenerative lidelser, " sagde Sahay. "Disse modulære CSPN'er kunne være en ny platform til levering af molekyler på tværs af biologiske barrierer, der menes at være uigennemtrængelige. Og små ændringer kan lede selvsamling til utallige definerede nanostrukturer, hvilket gør dem ideelle værter for en række forskellige molekyler."
 Varme artikler
Varme artikler
-
 Brug af grafenskum til at detektere subtile spor af farlige gasser, sprængstofferFazel Yavari Fazel Yavari har udviklet en ny sensor til at detektere ekstremt små mængder af farlige gasser. Rensselaer Polytechnic Institute doktorand udnyttede kraften i verdens tyndeste materia
Brug af grafenskum til at detektere subtile spor af farlige gasser, sprængstofferFazel Yavari Fazel Yavari har udviklet en ny sensor til at detektere ekstremt små mængder af farlige gasser. Rensselaer Polytechnic Institute doktorand udnyttede kraften i verdens tyndeste materia -
 Zero gravitation graphene lover succes i rummetProfessor Ferrari under flyvningen. Kredit:University of Cambridge I en række spændende eksperimenter, Cambridge -forskere oplevede vægtløshed ved at teste grafens anvendelse i rummet. Arbejder s
Zero gravitation graphene lover succes i rummetProfessor Ferrari under flyvningen. Kredit:University of Cambridge I en række spændende eksperimenter, Cambridge -forskere oplevede vægtløshed ved at teste grafens anvendelse i rummet. Arbejder s -
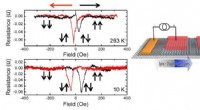 Forskere udvikler en ny homøpitaksial grafentunnelbarriere/transportkanal spintronisk enhedLav temperatur og stuetemperatur drift af den homoepitaksiale grafen-spinventil (venstre) og en skematisk (til højre) af en af de homoepitaksiale fluorerede grafen-/grafen-spinventilenheder. Distink
Forskere udvikler en ny homøpitaksial grafentunnelbarriere/transportkanal spintronisk enhedLav temperatur og stuetemperatur drift af den homoepitaksiale grafen-spinventil (venstre) og en skematisk (til højre) af en af de homoepitaksiale fluorerede grafen-/grafen-spinventilenheder. Distink -
 Forskere bruger verdens mindste diamanter til at lave ledninger tre atomer brede (Opdatering)Denne animation viser molekylære byggesten, der forbinder spidsen af en voksende nanotråd. Hver blok består af en diamantoid - den mindst mulige smule diamant - knyttet til svovl- og kobberatomer (g
Forskere bruger verdens mindste diamanter til at lave ledninger tre atomer brede (Opdatering)Denne animation viser molekylære byggesten, der forbinder spidsen af en voksende nanotråd. Hver blok består af en diamantoid - den mindst mulige smule diamant - knyttet til svovl- og kobberatomer (g


