Observation af cellulær aktivitet, et molekyle ad gangen
Proteiner og molekyler samles og adskilles naturligt som en del af mange essentielle biologiske processer. Det er meget svært at observere disse mekanismer, som ofte er komplekse og finder sted på nanometerskalaen, langt mindre end det normale synlige område. Hos EPFL, imidlertid, et tværfagligt team af forskere har opfundet og anvendt en teknik, der gør det muligt at undersøge disse mekanismer med hidtil uset præcision. Deres arbejde er genstand for et papir udgivet i Natur nanoteknologi .
Nanometriske strukturer kan kun ses med specialmikroskoper, såsom atomkraftmikroskoper, som blev opfundet i midten af 1980'erne. Disse instrumenter skaber et billede ved fysisk at "føle" topografien af prøven med en atomisk skarp spids for enden af en lille cantilever. Prøven scannes derefter punkt for punkt for at skabe et billede. Da dette tager tid, kun statiske prøver kan afbildes med konventionelle atomkraftmikroskoper. Imidlertid, det nytter ikke noget, når videnskabsmænd vil se på små prøver, der ændrer sig over tid, såsom proteinsamlinger.
"Forandring er afgørende for levende stof og er derfor afgørende for biologiske processer, " forklarer prof. Georg Fantner, der leder EPFL's Laboratory for Bio- og Nano- Instrumentation (LBNI). "Så det var vigtigt, at vi fandt en måde at observere det på."
For at observere processer på en prøve, der ændrer sig over tid, scanningshastigheden skal øges. Imidlertid, i traditionelle hurtige atommikroskoper, de kræfter, der udøves af målingen, kan interferere med den molekylære samlingsproces, især da proteinsamlinger ofte er meget skrøbelige. EPFL-forskerne fandt en metode, der løste problemet, ved at styre den fysiske interaktion af den skarpe spids meget præcist ved hjælp af pulserende laserlys. Dette øgede scanningshastigheden dramatisk, samtidig med at den blide, men ekstremt præcise scanningsbevægelse bevares.
2, 000 linjer i sekundet
"Vi opnåede dette ved at bruge to lasere i mikroskopet, hvoraf den ene peger på bunden af udkragningen, lokalt opvarme det og derved bøje det lidt, siger Adrian Nievergelt, en ph.d. studerende ved LBNI og medførsteforfatter af papiret. "Ved at bøje udkraget, vi kan undersøge overfladen meget hurtigere, mens du stadig holder fin kontrol over den overordnede bevægelse. Ud over, vi forbedrede det overordnede systems ydeevne, giver os mulighed for at scanne op til 2, 000 linjer i sekundet."
Forskerne testede denne nye teknologi for at analysere dynamikken i SAS-6-proteinringdannelsen. Denne proteinfamilie spiller en nøglerolle i samlingen af centrioler, som er små organeller, der er bevaret fra alger til mænd, grundlæggende for cellemotilitet og deling. Det nye instrument gjorde det muligt for forskerne for første gang at visualisere de forskellige stadier af ringsamlingen af SAS-6-proteiner i realtid "Dette er en kritisk game changer for feltet", siger prof. Pierre Gönczy, ekspert i centriolebiologi og medforfatter til undersøgelsen. "Nu har vi endelig en metode til direkte at observere, hvordan denne kritiske cellulære komponent er samlet til en ringlignende polymer", tilføjer Niccolò Banterle, en post-doc stipendiat i Gönczy-laboratoriet og medførsteforfatter af undersøgelsen. "Dette giver os mulighed for bedre at forstå, hvordan naturen styrer samlingen af nogle af livets mindste byggesten."
 Varme artikler
Varme artikler
-
 Indtagede nanopartikler kan være sundhedsskadeligeEt tarmcelle-monolag efter eksponering for nanopartikler, vist med grønt. (PhysOrg.com) -- Milliarder af konstruerede nanopartikler i fødevarer og lægemidler indtages af mennesker dagligt, og ny C
Indtagede nanopartikler kan være sundhedsskadeligeEt tarmcelle-monolag efter eksponering for nanopartikler, vist med grønt. (PhysOrg.com) -- Milliarder af konstruerede nanopartikler i fødevarer og lægemidler indtages af mennesker dagligt, og ny C -
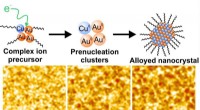 Nanoskala billeddannelsesmetode giver indsigt i legerede nanopartikelsynteseLegerede nanokrystaller. Kredit:Mei Wang for UMD Katalysatorer, ofte metal nanopartikler, er involveret i produktionen af over 80 % af kommercielle produkter såsom plastik, brændstoffer og lægem
Nanoskala billeddannelsesmetode giver indsigt i legerede nanopartikelsynteseLegerede nanokrystaller. Kredit:Mei Wang for UMD Katalysatorer, ofte metal nanopartikler, er involveret i produktionen af over 80 % af kommercielle produkter såsom plastik, brændstoffer og lægem -
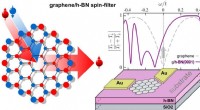 Grafenflager til fremtidige transistorerTil venstre:Dette er et spin-filter lavet af en magnetisk nanoflake:en strøm af elektroner med spin op og ned i lige store forhold strømmer gennem enheden. På grund af destruktiv interferens i en spin
Grafenflager til fremtidige transistorerTil venstre:Dette er et spin-filter lavet af en magnetisk nanoflake:en strøm af elektroner med spin op og ned i lige store forhold strømmer gennem enheden. På grund af destruktiv interferens i en spin -
 Ekstremt stærkt og hurtigt lysEn cæsium blybromid nanokrystal under elektronmikroskopet (krystalbredde:14 nanometer). Individuelle atomer er synlige som punkter. Kredit:ETH Zürich / Empa / Maksym Kovalenko Et internationalt te
Ekstremt stærkt og hurtigt lysEn cæsium blybromid nanokrystal under elektronmikroskopet (krystalbredde:14 nanometer). Individuelle atomer er synlige som punkter. Kredit:ETH Zürich / Empa / Maksym Kovalenko Et internationalt te
- Evakueringer, da Gran Canaria ramt af ny flamme
- Ford lukker walisisk fabrik med tab på 1, 700 arbejdspladser
- En spand fuld af fotoner kan give fingerpeg om solens magnetfelter
- Hvor præcise er dybhavsoliescannere?
- Giver mens hun er kvinde:Kvinder er mere tilbøjelige til at donere til velgørende formål end mæn…
- Forskning og politik i et Arktis i forandring


