Minimalistiske biostrukturer designet til at skabe nanomaterialer
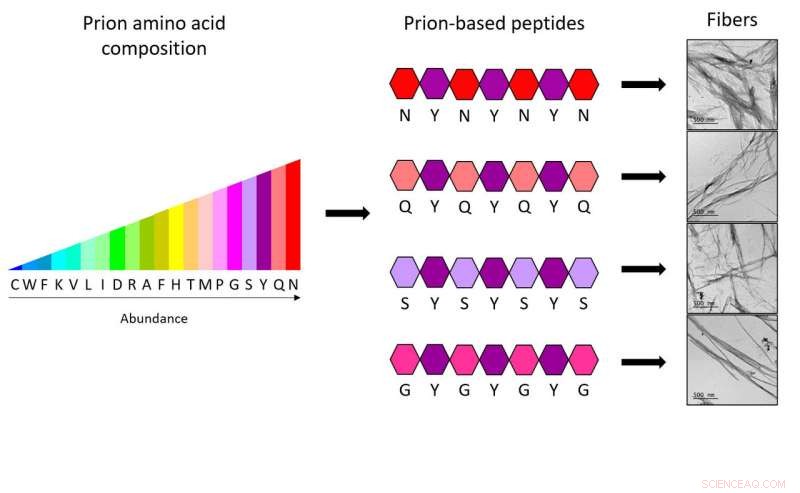
Med de nye heptapeptider, forskere fra IBB-UAB viser, at kun fire forskellige aminosyrer, distribueres på en bestemt måde og kombineres altid med en anden femte type, er nok til at opnå den komplette kode, der er nødvendig for at danne syntetiske prionfibre. Kredit:IBB-UAB
Forskere ved Institut for Bioteknologi og Biomedicin (IBB-UAB) har genereret fire peptider, molekyler mindre end proteiner, stand til selvsamling på en kontrolleret måde til dannelse af nanomaterialer. Forskningen, offentliggjort i tidsskriftet ACS Nano , blev udført af Salvador Ventura, Marta Díaz Caballero og Susanna Navarro (IBB-UAB), og omfattede samarbejdet mellem Isabel Fuentes og Francesc Teixidor (Institute of Materials Science of Barcelona, ICMAB-CSIC).
De nye molekyler dannes af en kæde på syv aminosyrer, som hver især består af to aminosyrer, og dermed fremskynde og reducere omkostningerne ved at skabe funktionelle syntetiske amyloidstrukturer til frembringelse af nanomaterialer til biomedicin og nanoteknologi.
Inden for bioteknologi, generering af funktionelle syntetiske amyloidstrukturer til dannelse af nanostrukturer ved at efterligne den naturlige generationsproces er ikke nyt. Samlingen af proteiner til stabile fibre gør det muligt at skabe supramolekylære former, som intet isoleret protein kan skabe, og som bruges som nanoledere, solcelleanlæg, biosensorer og katalysatorer.
For nylig, forskere begyndte at syntetisere prions proteinsekvenser til dannelse af nanomaterialer. Interessen for disse sekvenser ligger i det faktum, at proteinerne samles på en langsommere og mere kontrolleret måde, danner højtordnet, ikke -toksiske nanostrukturer. Imidlertid, det faktum, at sekvensen er så lang, med over 150 aminosyrer, gør det meget svært og dyrt at syntetisere.
"Vi har vist, at et passende design kan tillade, at størrelsen af syntetiske prionsekvenser reduceres til kun 7 aminosyrer, samtidig med at de samme ejendomme bevares. De fire peptider, vi har fremstillet, er de korteste strukturer af denne type, der er skabt indtil nu, og er i stand til at danne stabile fibrilsamlinger, "siger Salvador Ventura, forsker ved IBB og UAB Institut for Biokemi og Molekylærbiologi.
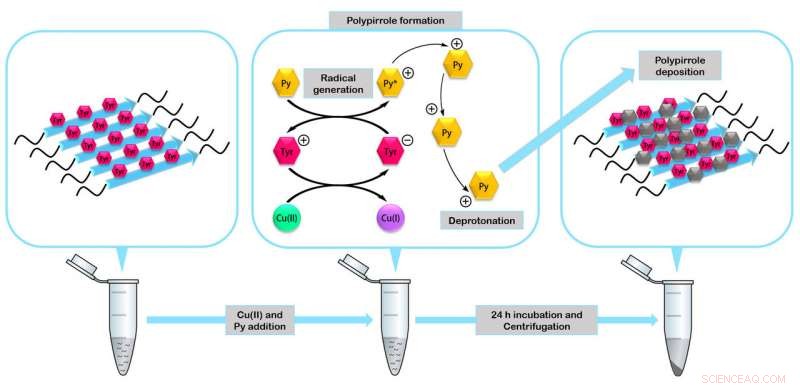
Peptiderne samles til dannelse af miniaturenzymer, der er i stand til at virke som katalysatorer i dannelsen af nanomaterialer, såsom den ledende polymerpolypyrrol. Kredit:IBB-UAB
I undersøgelsen, forskerne verificerede stabiliteten og funktionaliteten af de fire fremstillede peptider. De byggede et af de mest nedbrydningsresistente biologiske nanomaterialer, der er beskrevet til dato, nanokabler dækket af sølv, der kan fungere som elektriske nanoledere og fibrillære mini -enzymer, der kan fungere som katalysatorer i dannelsen af organiske nanomaterialer.
De nye molekyler har mange anvendelser, men forskerne sigter mod at fokusere på "generering af elektriske nanoledere og gøre brug af kendskabet til amyloidstrukturen til at generere syntetiske fibre, der er i stand til at være katalysatorer for nye kemiske reaktioner. Det endelige mål vil være at generere hybridpeptid-uorganiske materialer, der kan laver komplekse reaktioner, som dem, der er skabt af planters fotosystemer, "påpeger IBB -forskeren.
Prion -domæner, i sagens hjerte
For at generere nye peptider, IBB -forskere baserede deres arbejde på specifikke sekvenser af prionproteiner, kendt som prion -domæner (PrD'er). "Vi studerede, hvilke aminosyrer der er hyppigere, og hvordan de fordeles i disse regioner, demonstrerer, at kun 4 forskellige typer aminosyrer fordelt på en bestemt måde og altid kombineret med en femte type aminosyre er tilstrækkelige til at have den komplette kode, der er nødvendig for at danne syntetiske prionfibre. Faktisk, hver af de heptapeptider (mini-PrD'er), der er designet, indeholder kun to forskellige typer aminosyrer, ”siger Salvador Ventura.
Undersøgelsen demonstrerer evnen til at samle mini-PrD'er til højtordnede nanostrukturer, en proces, der menes at være umulig i betragtning af den store tilstedeværelse af polære aminosyrer. De resulterende peptider er mere polære end noget andet peptid af lignende størrelse, der hidtil har været anvendt til dannelse af syntetiske amyloider; det her, for eksempel, giver dem mulighed for at fungere under de samme betingelser som naturlige enzymer.
Denne undersøgelse har hjulpet forskere fra gruppen IBB Protein Folding and Conformational Diseases, instrueret af Dr. Ventura, at åbne en ny forskningslinje med fokus på design af nanomaterialer.
"Vi har aldrig arbejdet med nanoteknologi, men samtidig har vi altid haft det nær, fordi vores styrke ligger i kendskabet til den molekylære mekanisme for proteinsamling til amyloidstrukturer. I lang tid har vi arbejdet på at skabe strategier til at undgå dette fænomen i neurodegenerative sygdomme. Denne viden har givet os mulighed for at designe nye molekyler, som vi nu foreslår til fremstilling af nye nanomaterialer, "Dr. Ventura slutter.
Sidste artikelGraphen sætter sit præg på gasseparation
Næste artikelForskning viser vejen til mere pålidelig kulstofbaseret mikroelektronik
 Varme artikler
Varme artikler
-
 Eksotiske nanorør bevæger sig på mindre mystiske måderRice University kandidatstuderende Ashleigh Smith McWilliams har et hætteglas med fluorescerende bornitrid -nanorør. Hun ledede en undersøgelse for at optage video af nanorørene i bevægelse for at bev
Eksotiske nanorør bevæger sig på mindre mystiske måderRice University kandidatstuderende Ashleigh Smith McWilliams har et hætteglas med fluorescerende bornitrid -nanorør. Hun ledede en undersøgelse for at optage video af nanorørene i bevægelse for at bev -
 Små bobler knækker kulstofnanorør som kvisteDen mekanisme, hvorved kulstofnanorør knækker eller bøjer under påvirkning af bobler under sonikering, er emnet for et nyt papir ledet af forskere ved Rice University. Holdet fandt ud af, at korte nan
Små bobler knækker kulstofnanorør som kvisteDen mekanisme, hvorved kulstofnanorør knækker eller bøjer under påvirkning af bobler under sonikering, er emnet for et nyt papir ledet af forskere ved Rice University. Holdet fandt ud af, at korte nan -
 Udvikling af nye elektronmikroskopiteknikker til at udtrække sløret information om materialeegensk…Diagrammer, der illustrerer arbejdsprincippet for firepunktsprobeteknikken ved hjælp af et spektroskopisk mikroskop. Kredit:National Institute for Materials Science NIMS-forskere Bo Da (forsker ve
Udvikling af nye elektronmikroskopiteknikker til at udtrække sløret information om materialeegensk…Diagrammer, der illustrerer arbejdsprincippet for firepunktsprobeteknikken ved hjælp af et spektroskopisk mikroskop. Kredit:National Institute for Materials Science NIMS-forskere Bo Da (forsker ve -
 Forskere skaber atomtykke legeringer med uforudsete magnetiske egenskaberEt højvinklet ringformet mørkfeltbillede af rent rheniumdiselenid. I tasten nederst til højre, rhenium atomer er blå og selen atomer gule. Kredit:Oak Ridge National Laboratory Udskiftning af atome
Forskere skaber atomtykke legeringer med uforudsete magnetiske egenskaberEt højvinklet ringformet mørkfeltbillede af rent rheniumdiselenid. I tasten nederst til højre, rhenium atomer er blå og selen atomer gule. Kredit:Oak Ridge National Laboratory Udskiftning af atome
- Ingeniører løser 50 år gammelt puslespil inden for signalbehandling
- Team beregner rollen af begravede lag i få-lags epitaksial grafen
- Nanoskala optisk pulsbegrænser lettet af ildfaste metalliske kvantebrønde
- Billede:ISS passerer månen
- NASA ser sen -sæson Atlantic Tropical Depression form
- Krydstogtkøberes kontraintuitive svar på priserne kan hjælpe industrien med at reversere post-pan…


