En ny tilgang til studiet af integrale membranproteiner
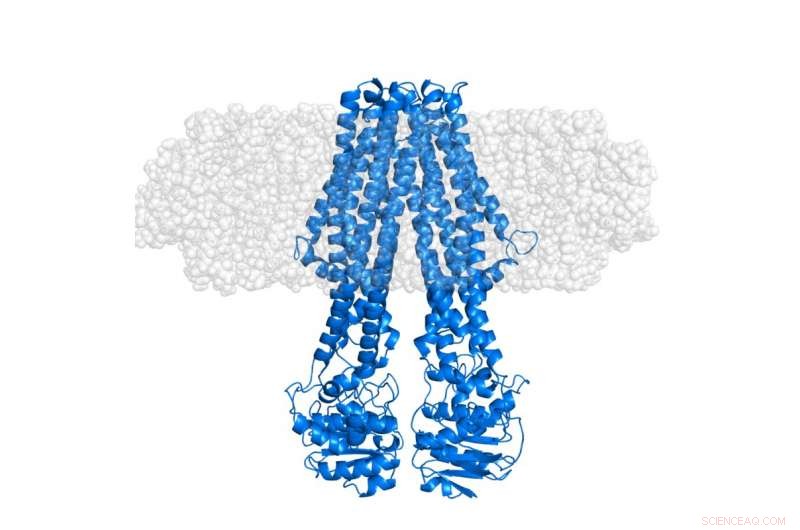
Det integrerede membranprotein MsbA (blå) indlejret i en 'semi-transparent' membranøs nanodskive (grå). Selve nanoskiven er, gennem selektiv deuteration, gjort usynlig i SANS-eksperimenter, der fokuserer på konformationen af proteinet i dets native kontekst. Kredit:Institut Laue-Langevin
Membranerne, der omgiver vores celler, indeholder et stort antal proteiner. Membranproteiner er derfor en afgørende klasse af makromolekyler i levende systemer. De spiller nøgleroller, såsom at sørge for transport gateways ind og ud af cellen, lette signalering mellem celler, samt at være involveret i enzymkatalyse. Disse funktionelle roller gør dem særligt vigtige som lægemiddelmål, med størstedelen af nuværende terapeutiske midler rettet mod membranproteiner.
Imidlertid, strukturelle undersøgelser af integrale membranproteiner (IMP'er) har vist sig ekstremt udfordrende, da de fleste af dem er svære at studere ordentligt i fravær af deres lipidmiljø. Dette forhindrer dem ofte i at blive krystalliseret - en metode, der almindeligvis anvendes i klassisk strukturbiologi. Der kræves derfor alternative tilgange til strukturelle undersøgelser af IMP'er i membranøse miljøer. Til dette formål, Life Sciences Group ved Institut Laue-Langevin (ILL), i samarbejde med Københavns Universitet, har med succes været banebrydende i udviklingen af stealth carrier nanodiscs. I denne tilgang en sofistikeret deuterium-mærkningsmetode bruges til at gøre membranen effektivt usynlig for neutrondiffraktion med lav opløsning, mens den stadig fremhæver strukturen af IMP'er i deres sædvanlige lipidmiljø, som offentliggjort i Acta Crystallographica D i 2014.
For nylig, den første strukturelle undersøgelse af et integreret membranprotein ved hjælp af denne stealth carrier nanodisc deuterationsstrategi er netop blevet afsluttet. Dette blev udført ved hjælp af Deuteration Laboratory (D-Lab) platformen fra Partnership for Structural Biology (PSB) i forbindelse med small-angle neutron scattering (SANS) og X-ray scattering (SAXS) leveret gennem PSB SANS/SAXS platformen . Som offentliggjort i tidsskriftet Struktur af Josts et al. det internationale hold, ledet af Henning Tidow, Universitetet i Hamborg, anvendte denne metode på et ATP-bindende kassette (ABC) transporterprotein, MsbA – som spiller en vigtig rolle i lipidtransport i bakterier. De resulterende neutronspredningsdata, for det meste erhvervet ved hjælp af D11-instrumentet på ILL, tillod direkte observation af signalet fra det solubiliserede membranprotein uden bidrag fra det omgivende lipid. SAXS-dataene gav en klar reference til nanodiskens ydre form, inklusive lipid-dobbeltlaget.
Ud over, konformationelle ændringer i MsbA blev undersøgt, demonstration af metodens følsomhed og dens generelle anvendelighed til strukturelle undersøgelser af IMP'er.
Denne tilgang vil sandsynligvis blive stadig vigtigere i fremtidige undersøgelser af disse vanskelige, men kritisk vigtigt, biologiske makromolekyler, til gengæld understøtter en bedre forståelse for udviklingen af lægemidler rettet mod membranproteiner.
 Varme artikler
Varme artikler
-
 Hurtigere fotoner kunne muliggøre total datasikkerhedElektrisk indstillelig on-demand on-chip enkelt foton kilde aktiveret af en stærk Purcell effekt. Kredit:John OHara Forskere ved University of Sheffield har løst et nøglepuslespil i kvantefysik, d
Hurtigere fotoner kunne muliggøre total datasikkerhedElektrisk indstillelig on-demand on-chip enkelt foton kilde aktiveret af en stærk Purcell effekt. Kredit:John OHara Forskere ved University of Sheffield har løst et nøglepuslespil i kvantefysik, d -
 Forskere foreslår hurtig Ebola -test ved hjælp af nanoteknologiLigesom Ebola endelig var ved at falme fra overskrifterne, det kom tilbage i nyhederne med chokerende rapporter:en skotsk sygeplejerske genindlagt på hospitalet ni måneder efter at have slået Ebola, l
Forskere foreslår hurtig Ebola -test ved hjælp af nanoteknologiLigesom Ebola endelig var ved at falme fra overskrifterne, det kom tilbage i nyhederne med chokerende rapporter:en skotsk sygeplejerske genindlagt på hospitalet ni måneder efter at have slået Ebola, l -
 Elektrokemiske fingre låser op for batteriets indre potentialeMedlemmer af forskerholdet – inklusive (fra venstre) Jing Li, Erik Stach, Xiqian Yu, Dong Su, Xiao-Qing Yang, Kai He, og Huolin Xin - ved Center for Functional Nanomaterials på Brookhaven Lab Lith
Elektrokemiske fingre låser op for batteriets indre potentialeMedlemmer af forskerholdet – inklusive (fra venstre) Jing Li, Erik Stach, Xiqian Yu, Dong Su, Xiao-Qing Yang, Kai He, og Huolin Xin - ved Center for Functional Nanomaterials på Brookhaven Lab Lith -
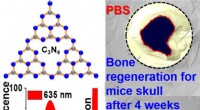 Ny stamcelleteknik viser løfte om knoglereparation(Øverst til venstre) Kemisk binding og fysisk struktur af C₃N₄4-ark. (Nederst til venstre) I flydende tilstand, rødt lys transmitteres ved maksimalt 450 nm og udsendes ved en bølgelængde på 635 nm. (T
Ny stamcelleteknik viser løfte om knoglereparation(Øverst til venstre) Kemisk binding og fysisk struktur af C₃N₄4-ark. (Nederst til venstre) I flydende tilstand, rødt lys transmitteres ved maksimalt 450 nm og udsendes ved en bølgelængde på 635 nm. (T


