Syntetiske og levende mikropropeller understøtter konvektionsforbedret nanopartikeltransport
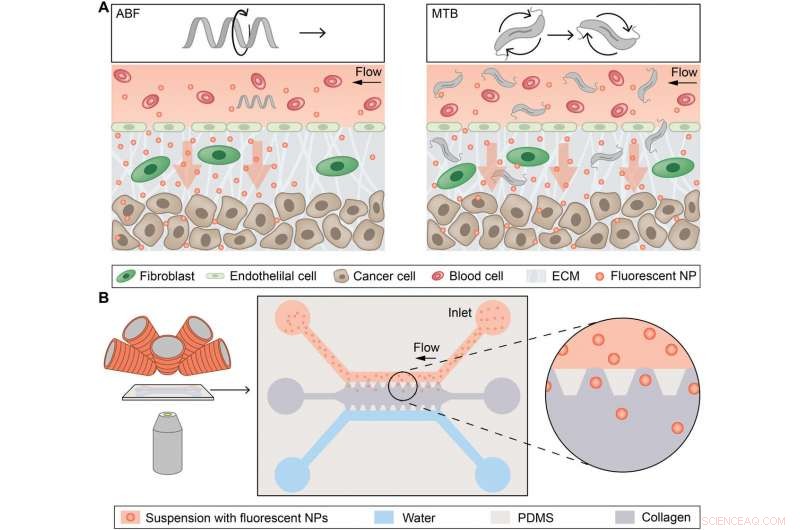
Konceptuel oversigt over magnetisk styrede mikropropeller til konvektionsforstærket NP-transport. (A) Konceptuel skematisk afbildning af en enkelt mikrorobot, det kunstige bakterielle flagelum (ABF), forbedring af massetransport af nanopartikler (NP'er) ved grænsefladen mellem kar og væv (venstre), og sværme af magnetotaktiske bakterier (MTB), der genererer konvektiv strømning for at forbedre massetransporten (til højre). ECM, ekstracellulær matrix. (B) Skematisk magnetofluidplatform til NP-massetransportundersøgelser ved hjælp af magnetisk induceret konvektion. Den mikrofluidiske chip er placeret mellem objektivlinsen på et omvendt optisk mikroskop og elektromagneterne (til venstre). Et skematisk billede viser chippen, bestående af en øvre kanal fyldt med NP'er (rød) og en nedre vandkanal (blå), der begge grænser op til en kollagenmatrix (grå) langs begrænsende trapezformede stolper lavet af PDMS. NP'er kan passivt diffundere ind i kollagenmatrixen langs deres koncentrationsgradient mod vandkanalen. Kredit: Videnskabens fremskridt , doi:10.1126/sciadv.aav4803
Nanopartikler (NP'er) er en lovende platform for lægemiddellevering til behandling af en række sygdomme, herunder kræft, hjertekarsygdomme og betændelse. Alligevel er effektiviteten af NP-overførsel til det syge væv af interesse begrænset på grund af en række fysiologiske barrierer. En væsentlig hindring er transporten af NP'er for præcist at nå målvævet af interesse. I en nylig undersøgelse, S. Schuerle og et team af tværfaglige forskere ved afdelingerne for Translationel Medicin, Biofysik, Engineering Robotics, Nanomedicin og elektronik, i Schweiz, Storbritannien og USA udviklede to særskilte mikrorobotbaserede mikropropeller for at løse udfordringen.
De brugte roterende magnetiske felter (RMF'er) til at drive enhederne og skabe lokal væskekonvektion for at overvinde den diffusionsbegrænsede transport af nanopartikler. Under den første eksperimentelle tilgang, de brugte en enkelt syntetisk magnetisk mikrorobot som en kunstig bakteriel flagel (ABF) og brugte derefter sværme af en naturligt forekommende magnetotaktisk bakterie (MTB) til at skabe en "levende ferrofluid" ved at udnytte ferrohydrodynamikken. Ved at bruge begge tilgange forbedrede forskerne transporten af NP'er i en mikrofluidisk model for ekstravasation af blod (bevægelse af et lægemiddel fra blodkar til det eksterne væv) og vævsgennemtrængning i mikrokanaler omgivet af en kollagenmatrix for at skabe en biomimetisk væv-kar-grænseflade i lab. Resultaterne af undersøgelsen er nu offentliggjort i Videnskabens fremskridt .
Nanopartikler (NP'er) er i stigende grad populære i nanomedicin på grund af biomedicinsk forskningspotentiale som bærere i lægemiddellevering, der overskrider grænserne for konventionel medicin. Mens NP'er er designet til at ændre farmakokinetikken og biodistributionen af eksisterende lægemidler, de er hæmmet af fysiologiske barrierer, som forhindrer vellykket ophobning på sygdomsstederne, begrænser deres terapeutiske virkninger in vivo. Under kræftbehandling, for eksempel, lægemiddelbærere støder på unormale kar, der omgiver tumorarkitekturen til ineffektiv intravenøs frigivelse af lægemiddel.
Da levering af NP'er til væv er stærkt påvirket af deres fysisk-kemiske egenskaber, forskere har redesignet NP-formerne og -størrelserne for at optimere deres transportkinetik gennem karvæggene for at nå væv. Forskere havde tidligere foreslået flertrinstilgange til optimeret lægemiddellevering, enten ved at krympe nanopartikler i tide, eller fragmentering af dem for først at spredes og nå et sted af interesse efter at have stødt på mikromiljømæssige tegn på sygdom in vivo.

Den kunstige bakterielle flagellum (ABF) i en mikrokar-lignende en-væske flow enhed. Kredit:Science Advances, doi:10.1126/sciadv.aav4803
Generelt, NP-transport påvirkes af overfladeladning, hydrofobicitet og overfladebiokemi; egenskaber, der aktivt kan optimeres i forskningsarbejde for mere effektiv in vivo-handel. Forskere har brugt eksterne energikilder såsom magnetiske og akustiske kræfter til at skabe trådløst kontrollerede mikrobots og transportere terapierne til sygt væv for forbedret diffusiv transport. Imidlertid, disse metoder var stadig afhængige af diffus transport efter at have frigivet deres last om bord, mens der stadig er behov for mere distinkte transportstrategier til et defineret sted.
I nærværende arbejde, Schuerle et al. detaljerede to distinkte strategier til at generere trådløst lokaliseret konvektiv flow for at forhindre invasiviteten af implanterede nanopartikler. Inspireret af området for mikrorobotter (mikrorobotter), videnskabsmændene brugte (1) en enkelt, syntetisk, bakterie-inspireret mikrorobot, eller (2) store sværme af levende bakterier til at drive lokaliseret NP-transport. De kunstige og naturlige mikropropeller assisterede processen ved at fremme magnetisk drevet konvektion til et defineret sted i en magnetofluidisk opsætning med potentiale for terapeutiske anvendelser.
Den syntetiske mikrobot imiterede bakteriel fremdrift ved hjælp af en kunstig bakteriel flagelum (ABF), mens de tætte sværme af magnetotaktiske bakterier (MTB) udnyttet af Schuerle et al. forekom naturligt som gramnegative prokaryoter ( Magnetospirillum magneticum ) med magnetiske egenskaber. Forskerne forventer, at resultaterne vil overvinde eksisterende transportbarrierer for forbedret NP-vævspenetration via trådløs kontrol og rumligt præcis lokal konvektion i fremtiden.
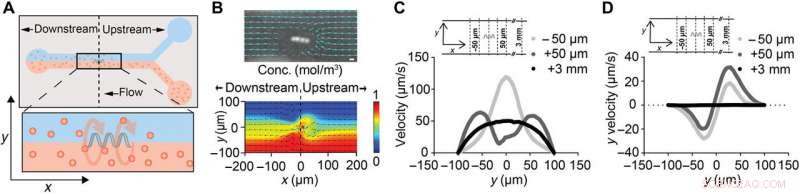
ABF forstyrrer lokalt væskestrømmen. (A) Skematisk af en 200 μm bred mikrofluidisk kanal med suspenderet ABF (36 μm lang, 10 μm i diameter) placeret ved kanalens centrum (x, y, z) =(0, 0, 0). Den øverste kanal indeholder vand, hvorimod den nedre kanal indeholder 200-nm fluorescerende NP'er. (B) Snapshot af ABF i en 200 μm bred kanal, der forstyrrer de sporede stier af de 200 nm fluorescerende NP'er, hvilket indikerer væskestrøm. Målestok (øverst), 10 μm. En numerisk simulering af to-væske flow med en ABF ved grænsefladen, med farve, der indikerer koncentrationsfordeling (rød, 1 mol/m3; blå, 0 mol/m3) af molekylære arter (nederst). (C) Hastighedsprofil ved positioner opstrøms og nedstrøms for ABF. Til kontrol, ved x =+3 mm, en uforstyrret laminær profil med en tophastighed på 50 μm/s blev simuleret. Ved både x =+50 μm (opstrøms) og x =-50 μm (nedstrøms), en stigning i tophastigheder forudsiges, med toppen flyttet tættere mod kanalvæggen for opstrømshuset. (D) Simuleringsresultater for y-hastighedskomponenten uy (ortogonal til og ud af kanalen) i de samme positioner som (C). I nærheden af ABF, et tryk rettet ortogonalt i forhold til strømningsretningen mod kanalvæggen forudsiges. Kredit:Science Advances, doi:10.1126/sciadv.aav4803
Schuerle et al. konstruerede den magnetiske ABF ved hjælp af tredimensionel (3-D) litografi og metalaflejring, som tidligere rapporteret. De bioinspirerede mikrorobotter efterlignede de roterende flageller for effektiv fremdriftsbaseret bevægelse i mikroskalaen - hvor viskøse trækkræfter dominerer. De styrede ABF-bevægelsen med ensartede magnetfelter i 3-D-rotation ved hjælp af en trådløs magnetisk kontrolopsætning indeholdende elektromagneter arrangeret omkring en enkelt halvkugle.
Derefter monterede de opsætningen på et omvendt mikroskop for at spore de kontrollerede mikrorobotters bevægelser. De roterende magnetiske felter (RMF'er) tillod fremdrift og konvektiv strømning i den omgivende væske, og da forskerne nedsænkede ABF'en i en suspension af fluorescerende NP'er, de observerede kontrolleret flow til massetransport af NP'erne.
I forsøget de konstruerede det nederste lag af den mikrofluidiske kanal til at indeholde de 200 nm NP'er svarende til den størrelse, der bruges i kliniske applikationer, mens de på det øverste væskelag opretholdt en suspension af rent vandigt medium. Forskerne placerede ABF'en i midten af opsætningen for at opretholde dens position mod strømmen ved at kontrollere væskestrømmen i opsætningen. Dette arrangement af ABF i en mikrofluidisk kanal forstyrrede det laminære flow for at producere konvektion, som transporterede NP'er fra væskelaget i bunden til det øvre lag - for at nå kanalvæggen, dvs. interessestedet.
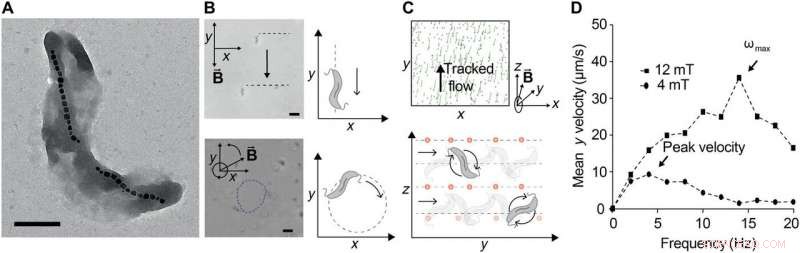
Ferrohydrodynamisk pumpning med kontrollerede sværme af MTB. (A) Transmissionselektronmikrofotografi af M. magnetisk stamme AMB-1. Målestok, 0,5 μm. Magnetosomerne er tydeligt synlige, her dannet i to adskilte strenge af jernoxidkrystaller. (B) Kontrol af AMB-1 under statiske magnetiske felter (øverst) og magnetiske felter, der roterer i planet ved 1 Hz. Målestok (nederst), 5 μm. (C) Efterbehandlede billeder af sporede, medsuspenderet, ikke-magnetisk, fluorescerende NP'er bruges til at observere strømningsfelter genereret af en sværm af MTB udsat for et 12-mT magnetfelt, der roterer ved 10 Hz i y-z-planet. Spor i grønt svarer til tilbagelagte baner over 12 billeder (~1 s). Positioner beregnes ved hjælp af båndpasfilter med 25-pixel diameter, efterfulgt af topfund (øverst). Bakteriel bevægelse kan styres ved at ændre retningen af vektoren af det roterende magnetfelt, fordi MTB'en oversættes inden for rotationsplanet (nederst). For en RMF-vektor omkring x-aksen, bakterier roterer langs y, generere et flow, der transporterer NP'er langs y. (D) Translationel hastighed er plottet versus anvendt rotationsfrekvens ved to forskellige magnetfeltstyrker. Translationshastigheden stiger med frekvensen i begyndelsen, men ved tilstrækkelig høje frekvenser, det falder, fordi det fluidiske trækmoment overvinder det magnetiske drejningsmoment for at forhindre dem i at følge med feltets rotation. Den maksimale synkroniserede frekvens, også svarende til den maksimale translationshastighed, omtales som udtrapningsfrekvensen ωmax. Når magnetfeltstyrken øges, udtrapningsfrekvensen stiger, som observeret. Kredit:Science Advances, doi:10.1126/sciadv.aav4803
Forskerne udviklede også en enkelt-væskestrømsmodel i en mikrokanal for at danne et bioinspireret mikrobeholder med biomimetiske skalaer og væskestrømningshastigheder. Modellen indeholdt koncentreret kollagen i midten, der efterlignede den native ekstracellulære matrix. Ved at bruge enheden, Schuerle et al. kvantificerede fluorescensintensiteten i den biomimetiske matrix for at teste, om den magnetisk kontrollerede ABF kunne øge massetransporten af fluorescensmærkede NP'er ind i den vævsefterlignende matrix. Resultaterne indikerede, at ABF'er var begrænset som en konvektiv mikropropller i mindre fartøjer, men dette kan ændres ved at skalere ABF-strukturen, så den passer til kanalstørrelsen i fremtiden.
Forskerne overvejede virkningerne af en hel sværm af mindre mikrorobotpropeller dernæst. For det, Schuerle et al. udvalgte vildtype MTB-stammen AMB-1 ( Magnetospirillum magneticum ) for at danne magnetosomer. Mikroorganismerne producerede naturligt kæder af jernoxidpartikler i lipid-dobbeltlag i plasmamembranen til manipuleret bevægelse ved hjælp af eksterne magnetfelter. Mens forskere havde brugt MTB'er i tidligere undersøgelser som potentielle vehikler til medicinafgivelse med eksterne magnetfelter, Schuerle et al. brugte rotationsmagnetiske felter (RMF'er) i dette arbejde. RMF'erne tvang bevægelsen af en MTB-sværm til at drive deres bevægelse via magnetisk drejningsmoment.
Kontrol af grønt fluorescerende mærket MTB i mikrofluidisk enhed, når RMF er tændt/slukket. Kredit:Science Advances, doi:10.1126/sciadv.aav4803
Forskerne sænkede den gennemsnitlige afstand mellem bakterierne ved at bruge en høj koncentration af MTB'er til at presse cellens naboer frem i 3-D sværme domineret af hydrodynamiske kræfter. De observerede ikke klyngedannelse eller aggregering af MTB-magnetosomerne, når de blev udsat for RMF'er, da magnetosomerne i sagens natur var afskærmet af bakteriecellemembranerne for kontrolleret væskestrøm. Schuerle et al. gentog eksperimenterne med biomimik ved hjælp af en mikrofluidisk enhed indeholdende kollagen for at vise, at MTB-sværme kunne trænge ind i kollagen, når der blev brugt tilstrækkeligt høje koncentrationer af MTB'er.
På denne måde ved hjælp af to eksperimentelle strategier Schuerle et al. forbedret massetransporten af NP'er, via konvektiv flow genereret af magnetisk styrede mikropropeller. De mikrorobotiske eksperimenter viste, at ABF efterlignede en bakteriel flagel for at hjælpe NP-akkumulering og penetration ind i en tæt kollagenmatrix - når den blev påvirket af RMF'er. Schuerle et al. foreslå at inkludere sådanne stationære ABF'er i stenter for at udløse lægemiddelfrigivelse og forbedre penetration på et sted af interesse for at modvirke inflammation efter behov.
Med den anden strategi, de fokuserede på at generere den samme teknik, men med magnetotaktiske bakteriestammer (MTB'er). Baseret på det nuværende arbejde og de eksisterende tumor-homing egenskaber af MTB'er, forskerne forestiller sig magnetisk kontrollerede sværme af 3-D MTB'er til at transportere NP'er i det interstitielle væskerum i tumormikromiljøer. Forskerne vil optimere tætheden af bakterier til en kompatibel dosis in vivo, og arbejdet vil bane vejen frem til yderligere undersøgelser af mikro- og nanomaterialer til magnetisk forbedret NP-transport i klinisk nanomedicin.
© 2019 Science X Network
 Varme artikler
Varme artikler
-
 Ny billedteknologi kan afsløre mobilhemmelighederDette billede illustrerer konceptet for en ny type teknologi, der kombinerer to biologiske billeddannelsesmetoder - atomkraftmikroskopi og nuklear magnetisk resonans - for at skabe en ny måde at stude
Ny billedteknologi kan afsløre mobilhemmelighederDette billede illustrerer konceptet for en ny type teknologi, der kombinerer to biologiske billeddannelsesmetoder - atomkraftmikroskopi og nuklear magnetisk resonans - for at skabe en ny måde at stude -
 Ny form for kvantestof:Naturlig 3D-pendant til grafen opdagetEn topologisk Dirac-halvmetaltilstand realiseres på det kritiske punkt i faseovergangen fra en normal isolator til en topologisk isolator. + og - tegnene angiver den lige og ulige paritet af energibån
Ny form for kvantestof:Naturlig 3D-pendant til grafen opdagetEn topologisk Dirac-halvmetaltilstand realiseres på det kritiske punkt i faseovergangen fra en normal isolator til en topologisk isolator. + og - tegnene angiver den lige og ulige paritet af energibån -
 Interferometrisk mikroskop afbilder nano-verdenenEt mikroskopisk 3D-billede af et lille område af et hyldevare guldbelagt spejl, fremstillet ved diamantdrejning. Den største trækstørrelse er omkring 30 nm høj, og overfladens gennemsnitlige ruhed er
Interferometrisk mikroskop afbilder nano-verdenenEt mikroskopisk 3D-billede af et lille område af et hyldevare guldbelagt spejl, fremstillet ved diamantdrejning. Den største trækstørrelse er omkring 30 nm høj, og overfladens gennemsnitlige ruhed er -
 Nanoantenner hjælper detektorer med at se mere varme, mindre støjSandia National Laboratories optiske ingeniør Michael Goldflam opsætter udstyr til at indlæse og karakterisere en ny nanoantenna-aktiveret detektor. Kredit:Randy Montoya Sandia National Laboratori
Nanoantenner hjælper detektorer med at se mere varme, mindre støjSandia National Laboratories optiske ingeniør Michael Goldflam opsætter udstyr til at indlæse og karakterisere en ny nanoantenna-aktiveret detektor. Kredit:Randy Montoya Sandia National Laboratori
- Ingeniører løser 50 år gammelt puslespil inden for signalbehandling
- Fysik studerende laver verdens mindste juletræ
- Små verdener kommer i fokus med det nye Sandia-mikroskop
- Grafkalkulatorkunst: Sådan oprettes et Face
- Sådan bygger du en pyramide til et skoleprojekt
- Papiret beskriver, hvordan L.A. County kan tilpasse sin vandforsyning til klimaændringer


