Hævning af væske omkring levende celler

Omkonfiguration af væskevæggenes mønstre. Se hele filmen på, Kredit:Science Advances, doi:10.1126/sciadv.aav8002
Cellekulturplader, der er til daglig brug i biologi, kan effektivt omdannes til mikrofluidiske enheder, åbne veje for biologer til at minimere cellebaserede arbejdsgange. I en nylig rapport, Ph.d. forsker Cristian Soitu og kolleger i afdelingerne for ingeniørvidenskab og patologi ved University of Oxford, Oxford, Storbritannien, beskrevet en enkel metode til at skabe mikrofluidiske arrangementer omkring celler. I undersøgelsen, cellerne voksede allerede på standard petriskåleoverflader, da forskerne brugte grænsefladen mellem de ikke -blandbare flydende medier i beholderen som et byggemateriale.
De omformulerede de konventionelle cellekulturretter til sofistikerede mikrofluidiske enheder efter behov ved at omforme væskestrukturer omkring levende celler. Soitu beskriver den nye væskeformningsteknik, som hans forskerhold har bygget, som "væskestrukturer for de celler med frygt for engagement, når de vælger et hjem-de kan let fjernes og nye (med en anden geometri) bygges på plads." Forskningen er nu offentliggjort den Videnskab fremskridt
Forskerne demonstrerede metoden ved hjælp af arbejdsgange, der involverer cellekloning; selektiv kloning af en specifik klon blandt andre i en skål; medicinsk behandling; og sårheling. Forskningsarbejdet viste en alsidig tilgang, koblet til biologisk venlige funktioner for at fremme mikrofluidik -teknologien blandt biologer. Mikrofluidikbaserede tilgange har vundet popularitet i mange arbejdsgange, selvom deres optagelse inden for almindelig biologi fortsat er langsom på grund af forskellige årsager, inklusive:
- Materiel uforenelighed til cellevækst
- Mikrofluidiske arkitekturer, der er lukkede og utilgængelige
- Forudbestemte geometrier, der ikke kan omkonfigureres under forsøg - hvilket medfører omkostninger ved fremstilling og drift
- Arbejdsgange designet af ingeniører, der ikke er i overensstemmelse med allerede eksisterende teknikker udviklet af biologer.
I fortiden, forskere skabte 3D-konstruktioner med flydende vægge på nanoskalaen, selvom deres biokompatibilitet stadig skal vurderes. I det nuværende arbejde, derfor, Soitu et al. udviklet en metode til at lave arrays af isolerede mikrofluidiske kamre på jomfruelige petriskåle til at rumme store arbejdsgange i cellebiologi. Mulige eksempler omfatter cellefodring og overførsel, kloning, kryokonservering, fiksering og immunolabeling, cellelyse og revers transkriptionspolymerasekædereaktion (RT-PCR) og CRISPR-Cas9 genredigering. I tidligere forsøg med sådanne arbejdsgange tilføjede forskere cellerne efter fremstilling af mikrofluidik.
I det nuværende arbejde, forskerne oprettede en række mikrofluidiske arrangementer på standard petriskåle indeholdende vedhæftende celler og omkonfigurerede dem i realtid. De isolerede og hentede cellekloner for at udføre proof-of-concept-lægemiddeltest og sårhelingsassays og introducerede den nye teknik til at oprette og omkonfigurere mikrofluidiske kredsløb på petriskåle, mens celler voksede og delte sig, med mange potentielle anvendelser inden for mainstream biologi.
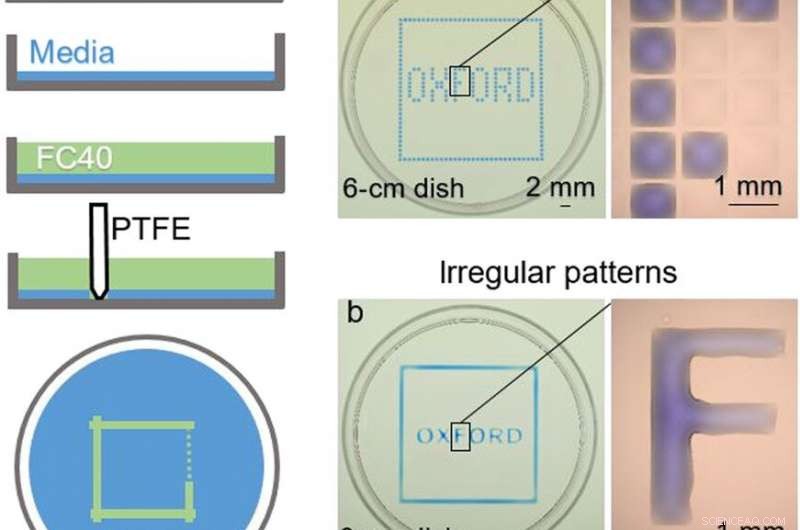
TOP:Kammerbygning. (A) Princip. Dulbeccos modificerede Eagle’s medium (DMEM) + 10% føtalt bovint serum (FBS) tilsættes til en jomfru petriskål, og det meste af mediet fjernes for at efterlade en tynd film, der dækker bunden, som er overlejret med FC40. Pennen flyttes henover bunden for at skabe et mikrofluidisk arrangement. Når den er færdig, det oprindelige volumen af DMEM + 10% FBS vil blive opdelt i to dele adskilt af en kontinuerlig flydende væg af FC40 fastgjort til substratet. (B) forskellige mønstre. (a) Dannelse af lodrette og vandrette linjer med lige store mellemrum skaber en matrix (32 × 32; 1 mm afstand). Næste, 60 nl blåt farvestof tilføjes af printeren til udvalgte kamre; perifere kamre modtager blåt farvestof for at give den blå firkant, og interne giver ordet "OXFORD." Forstørrelsen (til højre) viser individuelle kamre uden og med farvestof. (b) Et lignende mønster skabes ved at danne to firkanter (den ene lidt større end den anden) med pennen og derefter tilføje farvestof manuelt til mellemrummet; hvert bogstav fremstilles ved at danne dets sider og igen fylde det indre manuelt. Forstørrelsen viser, at bogstavet "F" er et kontinuerligt væskekrop. Fotokredit:Cristian Soitu, University of Oxford. BUND:Rekonfiguration af mikrofluidiske arrangementer. Billeder viser rammer fra filmen. (1) Et indledende mønster udskrives:en cirkel (radius, 1,5 mm) inde i en trekant (side, 7 mm) inde i en firkant (side, 9 mm). (2 til 4) Der tilsættes forskellige farvestoffer til hvert rum (1,5 pi rødt farvestof, 1,5 pi gult farvestof, og 5 pi blåt farvestof); farvestoffer er begrænset inden for FC40 -vægge. (5) Mere gult farvestof tilsættes til cirklen. (6) Efter tilsætning af 3 pi gult farvestof, den cirkulære fastgørelseslinje brister og indhold spildes ind i trekanten. (7) Efter tilsætning af 24 pi, den trekantede fastgørelseslinje brister og indhold spildes ind på pladsen. (8) 60 mikroliter trækkes tilbage fra pladsen. (9) Et nyt mønster udskrives - en trekant (side, 4,5 mm) i en cirkel (radius, 3,3 mm) - i den indledende firkant. (10 til 12) Farvede farvestoffer tilføjes til de tre forskellige rum som før. Fotokredit:Cristian Soitu, University of Oxford. Kredit:Science Advances, doi:10.1126/sciadv.aav8002
Den nye teknik og proof-of-concept-eksperimenterne
I de efterfølgende forsøg, forskerne dækkede først bunden af en petriskål med vævskulturmedium og fjernede det meste af mediet for at danne en tynd film, der dækkede polystyrensubstratet. De lagde den tynde film over med et ikke -blandbart fluorcarbon (FC40) for at forhindre fordampning og som en barriere mod eksterne forurenende stoffer for at opretholde sterilitet af mediet. Brug derefter et teflonspids, forskerne kontaktede bunden af fadet, forskydning af den vandige fase til dannelse af mikrofluidiske arrangementer i form af interesse - i dette tilfælde, en firkant. Ved hjælp af teknikken, forskerne bragte fordelene ved den åbne mikrofluidiske platform til standard cellekultur-ware.
Soitu et al. formede den vandige fase til at skabe et gitter med lave mængder væske som tidligere demonstreret af det samme team, og så dem med selektive farvestoffer i selektive kamre. For eksempel, perifere kamre modtog et blåt farvestof (der dannede en blå firkant), og dem i det indre dannede ordet "OXFORD".

Oprettelse af kamre til isolering af cellekloner. Se hele filmen på, Kredit:Science Advances, doi:10.1126/sciadv.aav8002
Forskerne "trykte" en cirkel inden for en trekant inden for en firkant og brugte mikroliter af tre farvestoffer til separat at se de tre former; hvor FC40 forhindrede farvestofferne i at blande sig. Resultaterne viste evne til at bygge og ødelægge FC40-vægge for effektivt at begrænse væskerne i enhver ønsket 2-D-form.
Efter de foreløbige proof-of-concept resultater, Soitu et al. genererede arrays af kamre for at rekapitulere kloning af musetumorceller (NM18), som de oprindeligt oprettede net, efterfulgt af celleaddition derefter. Forskerne lod først cellerne vokse frit omgivet af FC40 -væggen, der var gennemtrængelig for både O 2 og CO 2 , og derefter ved at vokse enkelte celler til kloner, før de omgiver dem med flydende vægge af forskellige former.
De viste, at væskevægge med forskellige 2-D-fodaftryk let kunne bygges omkring levende celler, så længe kolonierne forblev isolerede fra hinanden under efterfølgende behandling eller genfinding. Tidligere undersøgelser, der voksede celler inden for begrænsede, præmønstrede overflader krævede overfladebehandling før celleadhæsion-hvilket bidrager til den bemærkelsesværdige undtagelse i den foreliggende teknik.
Ansøgninger i klonplukning og lægemiddeltest
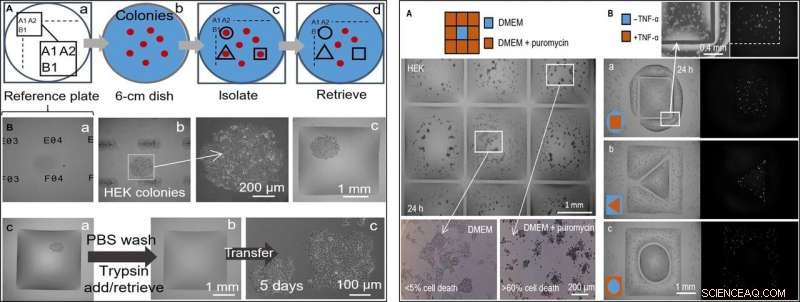
VENSTRE:Halvautomatiserende selektiv klonplukning (HEK-celler). Printeren tilføjer/fjerner en mikroliter til/fra kamre på forskellige stadier. (A) Fremgangsmåde. (a) Placeringer på en "referenceplade" af glas er markeret med unikke identifikatorer (dvs. A1, A2…, B1 ...). (b) En 6 cm skål med kolonier (rød) anbringes på referencepladen. (c) Efter at have registreret kolonilokationer og indtastet dem i et script, flydende vægge udskrives omkring udvalgte kloner (sorte linjer). (d) Kloner hentes fra disse kamre. (B) Isolering af en klon. HEK -celler blev udpladet ved lav densitet (~ 1 celle/cm2) og dyrket (8 dage) til kloner, fadet blev placeret på en referenceplade, og vægge blev bygget omkring udvalgte kloner. Tre forskellige z-akse visninger af en klon er vist. (a) Referenceplade med unikke identifikatorer i fokus. (b) Koloni i fokus (identifikatorer ude af fokus) med forstørrelse. (c) Koloni efter bygning af omgivende vægge. (C) Klonplukning. (a) Firkantmur bygget omkring en levende koloni. Printeren vasker celler ved at tilføje/hente 1 pi PBS; den tilføjer derefter 1 pi trypsin. (b) Fadet inkuberes (37 ° C; 5 min) for at løsne celler fra overfladen, og printeren henter 1 pi indeholdende den cellerige suspension (og overfører den til et mikrocentrifugerør) for at forlade det nu tomme kammer. (c) Hentede celler udplades manuelt i en 12-brønds mikrotiterplade og dyrkes konventionelt i 5 dage; celler fastgøres og vokser. Højre:To lægemiddelbehandlinger side om side med ubehandlede celler. Væskevægge blev bygget omkring HEK -celler (300, 000 celler; 6 cm fad) vokset i 24 timer. (A) Puromycin (3 × 3 gitter; 2 mm × 2 mm kamre). Printeren tilføjer 1 pi medium til det centrale kammer og 1 pi medium + puromycin til perifere (slutkoncentration, 10 μg/ml), som angivet i tegneserien. Cellelevedygtighed vurderes efter inkubation (37 °; 24 timer) ved anvendelse af et trypanblåt eksklusionsassay. Celler i ydre kamre er døde (mere end 60% i hver enkelt), der henviser til, at de i den centrale forbliver i live (mindre end 5% celledød). Denne analyse er blevet gentaget tre gange. (B) TNF-α. Par kamre med forskellige former er trykt, det ene omkring det andet. Printeren tilføjer 0,5 pi medium ± TNF-α (slutkoncentration, 10 ng/ml) til et eller andet volumen (som i tegnefilm). Da celler koder for et GFP-reportergen kontrolleret af en promotor, der er tændt af TNF-α, de fluorescerer grønt ved eksponering for cytokinet. Fluorescensbilleder viser, at kun celler i det behandlede volumen fluorescerer grønt. Volumenpar havde følgende dimensioner:(a) firkantet (side, 1,8 mm) i cirkel (radius, 1,75 mm); (b) trekant (side, 1 mm) i firkant (side, 3,5 mm); (c) cirkel (radius, 1 mm) i firkant (side, 3,5 mm). Kredit:Science Advances, doi:10.1126/sciadv.aav8002
I det næste trin, forskerne lavede en referenceplade, hvorpå de anbragte et fad indeholdende levende cellekolonier for at isolere cellekloner af interesse fra andre ved at udskrive væskevægge omkring dem. På isolation, de kunne vælge kolonierne, gendanne cellerne og dyrke dem konventionelt til at formere sig som forventet. Da væskevæggene effektivt kunne begrænse væskerne, Soitu et al. testet deres effektivitet ved at tilføje puromycin - en lille molekyle -translatorhæmmer, der dræber pattedyrsceller.
I den eksperimentelle opsætning af lægemiddelscreening, de tillod det centrale kammer at modtage vækstmedium alene, mens stoffet blev leveret til de omgivende kamre i en høj dødelig dosis, for at vise effektiviteten af FC40 -separation, når kun cellelinierne i det centrale kammer overlevede. I et andet eksempel, Soitu et al. udnyttet ejendommen af en human embryonisk nyrecellelinie, der er genetisk modificeret til at kode et grønt fluorescerende promotorgen. Som tændte i nærvær af tumornekrosefaktor-α til fluorescerende grøn. Væskevæggene dannede effektive barrierer for lægemiddeleksponering, verificering af teknikens potentiale for screening af lægemidler.
Ansøgninger i sårheling
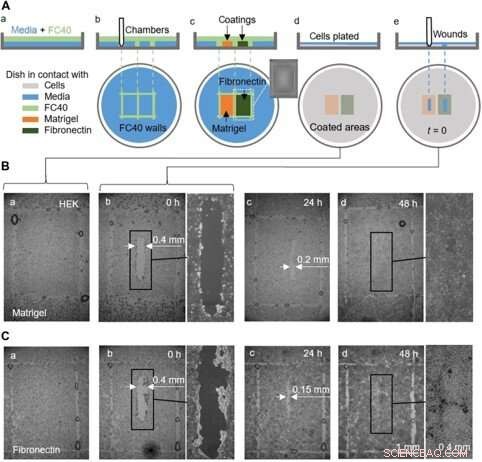
Et proof-of-concept sårhelingsassay ved hjælp af en skål, der er belagt med Matrigel og fibronectin i forskellige regioner. (A) tegneserie illustrerer arbejdsgang. (a) Et tyndt lag medie er overlejret med FC40. (b) To kamre (3 mm × 4 mm hver) udskrives side om side. (c) Overflader i kamre er belagt med Matrigel eller fibronectin (2 pi; slutkoncentration på 1 ug/cm2; 1 time); indsatsen viser et billede af et kammer. Væskevægge er nu ødelagt, og fadet vaskes med 3 ml medium for at fjerne ikke -vedhæftede belægninger. (d) HEK -celler (600, 000) er belagt i fadet. (e) Efter 24 timer, celler har dannet et monolag, og et sår (0,4 mm × 2 mm) dannes ved at skrabe pennen over overfladen for at fjerne celler i dens vej. Heling af såret overvåges nu mikroskopisk. (B og C) Billeder af sår i monolag dyrket på Matrigel eller fibronectin. (a og b) Umiddelbart før og efter sår (nogle dråber af FC40 forbliver der, hvor vægge oprindeligt stod). (c) Efter 24 timer, cellevækst reducerer sårbredder til <0,2 mm og <0,15 mm med Matrigel og fibronectin, henholdsvis. (d) Med 48 timer, sår er fuldstændig helet. Kredit:Science Advances, doi:10.1126/sciadv.aav8002
De gennemførte også proof-of-princip sårhelingsassays ved at bruge en enkelt skål belagt på to forskellige måder, at overvåge to sårhelingsbetingelser. For det, forskerne brugte Matrigel - et gelatinøst protein udskilt af sarkomceller og fibronectin - et glycoprotein i den ekstracellulære matrix, der forbedrede sårheling. De tilføjede HEK -celler, der dannede et monolag i fadene og skabte et "sår" ved at trække teflonspidsen hen over monolaget, når celler vandrede ind i sårene med lidt forskellige hastigheder. Selvom Soitu et al. overfladebehandlet overfladen før udpladning af celler, de kunne også ændre belægningsteknikken for dens tilføjelse, efter at cellerne begyndte at migrere ind i de nydannede sår for at fremme heling.
På denne måde, Cristian Soitu og kolleger udviklede en fleksibel, mikrofluid platform til miniaturisering af arbejdsgange i cellebiologi. De udvidede teknikken i det foreliggende arbejde til at danne mikrofluidiske arrangementer omkring præpletterede vedhæftende celler efterfulgt af en række forskellige principper om principper for cellekloning, lægemiddelscreening og sårheling. Platformen har mange fordele og kan erstatte den konventionelle tilstand med præfabrikerede mikrofluidiske enheder som et fleksibelt og tilpasseligt alternativ. De nye mikrofluidiske arrangementer bidrager omkostningseffektivt til nøjsom videnskab og kan omkonfigureres i realtid under et eksperiment for ekstra alsidighed. Forskerne noterer begrænsninger ved teknikken, inklusive 2-D begrænsede arrangementer og skrøbelighed af væskevægge i forhold til faste vægge. Soitu et al. håber at optimere og kombinere disse funktioner og fordele for at tilbyde en ny platform for almindelige biologer til at udforske mikrofluidikernes kraft.
© 2019 Science X Network
 Varme artikler
Varme artikler
-
 At bytte tellur med svovl forbedrer lysabsorptionen i organiske solcellerTellurholdige polymerbaserede solceller kan absorbere lys over et usædvanligt bredt spektrum og har potentialet til at forbedre energikonverteringseffektiviteten. Undersøgelsen af lysabsorberend
At bytte tellur med svovl forbedrer lysabsorptionen i organiske solcellerTellurholdige polymerbaserede solceller kan absorbere lys over et usædvanligt bredt spektrum og har potentialet til at forbedre energikonverteringseffektiviteten. Undersøgelsen af lysabsorberend -
 Lysere, mindre prober for at afdække proteiners hemmelige livBruce Cohen (rt) i laboratoriet med praktikant Katherine Chuang. (Phys.org) -- Forestil dig at spore en hjort gennem en skov ved at klippe en radiosender til øret og overvåge hjortens placering på
Lysere, mindre prober for at afdække proteiners hemmelige livBruce Cohen (rt) i laboratoriet med praktikant Katherine Chuang. (Phys.org) -- Forestil dig at spore en hjort gennem en skov ved at klippe en radiosender til øret og overvåge hjortens placering på -
 Ny metode til masseproduktion af grafen udvikletEt transmissionselektronmikroskopbillede af nanomaterialet grafen lavet med en ny teknik fra forskere ved Rensselaer. Den nye, stuetemperaturmetode kræver kun lidt forarbejdning og baner vejen for omk
Ny metode til masseproduktion af grafen udvikletEt transmissionselektronmikroskopbillede af nanomaterialet grafen lavet med en ny teknik fra forskere ved Rensselaer. Den nye, stuetemperaturmetode kræver kun lidt forarbejdning og baner vejen for omk -
 Rynker og krøller gør grafen bedreRynker og krøller, introduceret ved at placere grafen på krympende polymerer, kan forbedre grafens egenskaber. Kredit:Hurt and Wong Labs / Brown Unviversity Krølle et stykke papir, og det er sands
Rynker og krøller gør grafen bedreRynker og krøller, introduceret ved at placere grafen på krympende polymerer, kan forbedre grafens egenskaber. Kredit:Hurt and Wong Labs / Brown Unviversity Krølle et stykke papir, og det er sands
- Ingeniører behandler trykt grafen med lasere for at aktivere papirelektronik
- Forskere bruger lys til at dope grafenbornitrid-heterostrukturer
- Hvorfor er det vigtigt at være fortrolig med laboratorieapparater og deres anvendelser?
- Fysikere undersøger stadig dybere ind i universets ting
- Kaos, der holder dig varm:Forskere forbedrer varmeisolering ved hjælp af bevidst kaos
- Gamle Amazonas levede bæredygtigt - og det er vigtigt for bevaring i dag


