Isolering af intakte bakterier fra blod ved hjælp af en mikrofluidisk monolitanordning
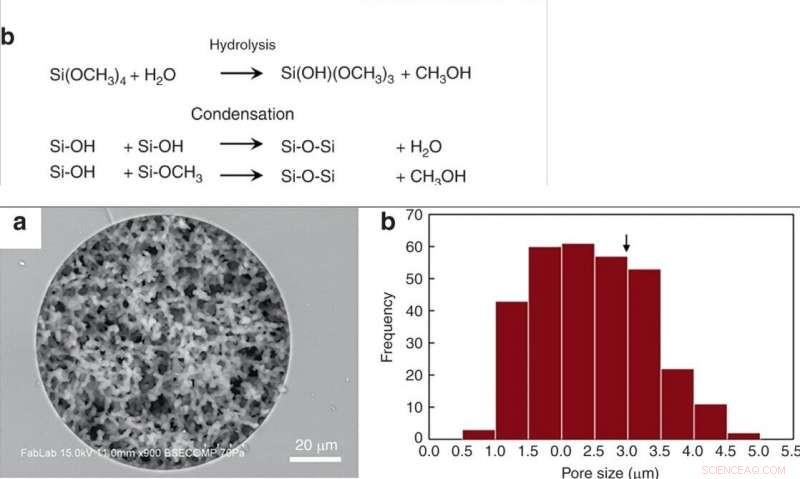
TOP:(a) Syntese af porøs silica monolit i smeltet silica kapillær og termoplastisk form via sol-gel kemi. (b) Konkurrencedygtige reaktioner under syntesen af monolit. Silanolgrupper til stede på glaskapillær danner kovalente bindinger med monolitten under dette trin. NEDERST:(a) SEM-billede af en silicamonolit syntetiseret inden for en 100 μm ID smeltet silicakapillar, afslører ensartet porøsitet og fremragende vægforankring af monolitten. (b) Histogram af porestørrelse. Kritisk diameter for RBC-hæmolyse (2r*) er markeret med en pil. Kredit:Microsystems &Nanoengineering, doi:10.1038/s41378-019-0063-4
Nye enkeltcellediagnostik er afhængige af potentialet til hurtigt og effektivt at isolere bakterier fra komplekse biologiske matricer. I en nylig undersøgelse offentliggjort i Mikrosystemer og nanoteknik , Jung Y. Han og kolleger ved de tværfaglige afdelinger for maskinteknik, Chemical Biomolecular Engineering og Bioengineering i USA udviklede en enhed til at isolere intakte og levedygtige bakterier fra fuldblod ved hjælp af en mikrofluidik, porøs silica monolit. De opnåede mekanisk hæmolyse, mens de sørgede for passage af intakte og levedygtige bakterier gennem monolitterne til størrelsesbaseret bakteriel isolering og selektiv lysis. Han et al. beskrev en proces til at syntetisere store mængder af diskrete kapillarbundne monolitelementer og millimeterskala monolit-klodser for at integrere i mikrofluidchips.
De undersøgte virkningen af monolitisk morfologi, geometri og strømningsbetingelser på cellelyse og strømningsregimer, der tillod selektiv cellelyse og selektiv passage af multiple gramnegative og grampositive bakterier. Teknikken anvendt af Han et al. tillod hurtig prøveforberedelse og bakteriel analyse i kombination med enkeltcellet Raman-spektrometri. Arbejdet giver unikke prøveforberedelsestrin til at understøtte hurtig og kulturfri bakteriel analyse til anvendelser i point-of-care biomedicinsk udstyr.
Bakterier i blodet kan føre til sepsis, infektion af væv og andre alvorlige medicinske tilstande, kræver tidlig identifikation af blodbårne bakterier for effektiv behandling. Evnen til hurtigt at identificere bakterier ved hjælp af point-of-care diagnostik kan i høj grad øge det kliniske potentiale for optimal behandling under tidlig infektion. Den eksisterende guldstandard for bakteriel karakterisering er baseret på fænotypisk cellekulturanalyse og kræver mindst 24 timer at indsamle prøver til kultur og analyse i et diagnostisk og klinisk mikrobiologilaboratorium. Den eksisterende teknik er robust og billig, men kan ikke generere rettidige resultater til at guide de indledende behandlingsstadier.
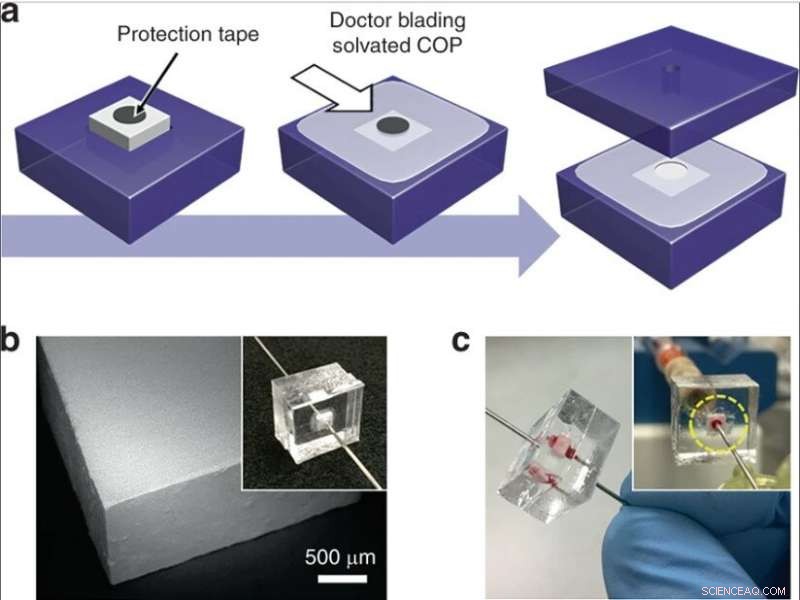
(a) Integration af en silica monolit mursten i en termoplastisk chip. Et cirkulært bånd anbringes på en monolit indsat i et COP-substrat, og solvatiseret COP påføres den eksponerede overflade. Efter delvis tørring, tapen fjernes, enheden er omsluttet af et andet COP-substrat, og væskeporte er indsat i huller, der giver en strømningsvej gennem monolitten. (b) SEM-billede af en monolit mursten skåret af skivesav. (c) Billede af en enhed under fuldblodsperfusion. Kredit:Microsystems &Nanoengineering, doi:10.1038/s41378-019-0063-4
I nærværende arbejde, Han et al. udforsket mikrofluidiske enheder integreret med porøse silica monolitter som simple gennemstrømningselementer til selektiv blodcelleanalyse og intakt isolering af bakterier. Monolitter er meget porøse materialer sammensat af åben celle morfologi med snoede veje af væskestrøm. Forskere kan kontrollere monolitisk poremorfologi via høj mekanisk overfladespænding under celleperfusion til mekanisk hæmolyse af blodceller, mens de tillader intakte og levedygtige bakterier at rejse de snoede strømningsveje for deres kulturfri isolering. Han et al. brugt tilgangen til selektiv passage for bakterier i fuldblod under strømningsbetingelser for gram-positive og gram-negative arter, trods forskelle i bakteriestammerne. Teknikken med high-throughput selektiv monolit lysis kombineret med kraftfulde analytiske metoder såsom Raman spektroskopi kan tillade dyrkningsfri analyse af bakterier i fuldblod på niveau med den enkelte celle.
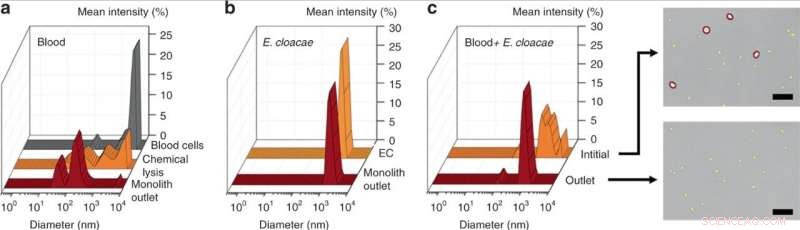
DLS -måling af (a) indledende 25 × fortyndet blod, kemisk lyseret blod, og blod lyseret ved perfusion gennem monolitanordningen, afslører en signifikant reduktion i celleaffaldsstørrelse for mekanisk monolitlysis i forhold til kemisk lysis. (b) DLS-måling af E. cloacae suspenderet i 1× PBS, og prøve perfunderet gennem monolitanordningen, viser ingen ændring i bakteriestørrelse. (c) DLS-måling af 100× fortyndet blod tilsat E. cloacae, og prøve opsamlet fra udløbet af en porøs monolit. Den brede top i indløbsprøven indikerer en blandet population af blodceller og små bakterieceller, hvorimod udløbsprøven viste signifikant reduktion i store (>2 µm) celler, som bekræftet på de optiske billeder. Skala søjler = 25 µm. Kredit:Microsystems &Nanoengineering, doi:10.1038/s41378-019-0063-4
Han et al. modificerede tidligere rapporterede silica monolit synteseprocesser, efterfulgt af hydrolyse og kondensation af silica til dannelse af silicaglas ved lave temperaturer. For at forberede silicamonolitten, forskerne brugte en forstadieopløsning sammensat af alkylsilicater, polyethylenglycol (PEG) som porogen, urinstof som en kilde til hydroxylioner for at minimere heterogenitet og eddikesyre. Da de optimerede den syntetiske proces, de resulterende monolitter var homogene og godt forankret til silicakapillærvæggene. Forskerne målte tykkelsen af den endelige skeletmonolitstruktur og beregnede dens permeabilitet ved hjælp af højtydende væskekromatografi til at kontrollere eksperimentelle forhold. For at minimere iboende variation, Han et al. skær de resulterende kapillarrør i 5 cm lange segmenter for at teste permeabilitet før brug.
De udviklede derefter to komplementære metoder til lav- og højkapacitetsdrift for at integrere silicamonoliter i mikrofluidiske systemer. For at tillade lav gennemstrømning, forskerne indlejrede monolitholdige kapillarsegmenter i termoplastiske mikrofluidiske chips for at beskytte monolitten under integrationen. Til selektiv lysis med høj gennemstrømning brugte de monolitter med større tværsnitsarealer i de mikrofluidiske enheder. Den komplette fremstillingsmetode gav fremragende pålidelighed til lækagefri drift under fuldblodsperfusion.
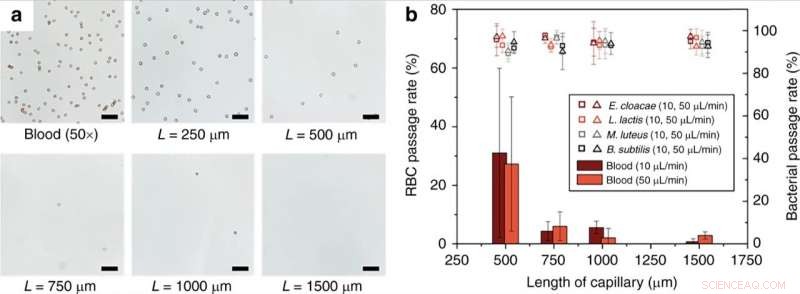
(a) Monolitlængdeafhængighed af RBC -hæmolyse. Helt, 50 × fortyndet blod i 1 × PBS blev perfunderet gennem kapillære monolitter af forskellige længder ved en strømningshastighed på 10 μL/min. (b) Passagehastighed for RBC og levedygtige bakterier ved forskellige strømningshastigheder og længder af monolitholdige kapillærer. Skala søjler = 50 µm. Fejlbjælker er ±1SD. Kontrasten af optiske billeder blev justeret for synlighed. Kredit:Microsystems &Nanoengineering, doi:10.1038/s41378-019-0063-4
Som bevis på princippet, Han et al. udvalgte Enterobacter cloacae (gram-negativ, stavformede bakterier) for at undersøge deres effektivitet ved passage, sammen med tre gram-positive bakterier; Lactococcus lactis, Micrococcus luteus og Bacillus subtilis. Under eksperimenterne de perfunderede bakterielle opløsninger gennem de mikrofluidiske monolitter med varierende geometri og strømningsbetingelser for at teste passage af bakterier og blodcellelyse ved hjælp af dynamisk lysspredning (DLS). For eksempel, perfusionen af oprenset E. cloacae gennem monolitten gav ikke mærkbare ændringer i DLS-toppene, indikerer intakt passage af bakterier.
Forskerne viste effekten af længden af den porøse monolit enhed på effektiviteten af røde blodlegemer (RBC). Resultaterne indikerede, at RBC-lyseeffektiviteten steg signifikant for monolitlængder over 1 mm. Han et al. undersøgte også skæbnen for hvide blodlegemer (WBC'er) under drift af monolitindretningen, cellerne kunne ikke passere gennem monolitten uden at blive lyseret svarende til røde blodlegemer. Teknisk set, RBC'er deformeres til en diskot form for at passere gennem monolit, hvilket forårsagede signifikant øget membranspænding til at resultere i RBC-lyse. Forholdsvis, bakterieceller havde samme dimensioner som monolitporerne og krævede derfor mindre cellevægsudvidelse for vellykket passage uden brud. Forskerne optimerede enhedens parametre til forskellige bakterier for at tolerere høje niveauer af membranstress uden at gå i stykker. Yderligere udvikling sikrede intakt passage af bakterier uden nedbrydning og med levedygtighed.
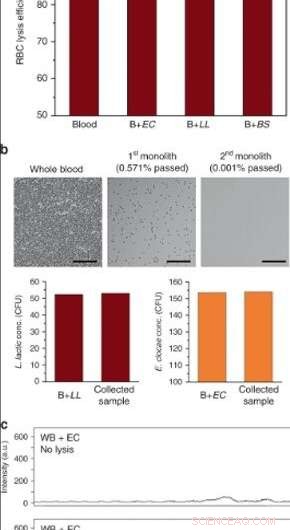
(a) RBC-lyseeffektivitet af fuldblod i højgennemstrømningsanordninger efter perfusion ved 10 μL/min (EC E. cloacae, LL L. lactis, BS B. subtilis. Fejlbjælker er ±SD. N = 3 for blod og B + EC, og N = 2 for B + LL, B + BS. (b) Blodcellelyse og bakterieseparation efter seriel operation ved anvendelse af to monolitter. Overflader blev passiveret med BSA/Tween 20. Over 99,999% RBC-lyse blev opnået, mens levedygtigheden af L. lactis og E. cloacae blev bevaret. Målestænger =100 µm. c Raman-spektre af fuldblod tilsat E. cloacae (øvre) før og (under) efter bearbejdning gennem porøs silicamonolit. Kredit:Microsystems &Nanoengineering, doi:10.1038/s41378-019-0063-4.
Til bakteriel passage med høj gennemstrømning, forskerne fortyndede blodet i kapillæranordningerne. Imidlertid, som et alternativ, de kunne også udvide monolittenes kapacitet til fuldblodslysis. Enhederne behandlede mere end 400 µL fuldblod fyldt med bakterier, før de udviste en betydelig stigning i modtryk, på grund af tilstopning som følge af cellelyse og også på grund af intakte leukocytter (WBC'er) fanget i den porøse matrix.
For at lokalisere målbakterier, Han et al. opnåede en prøve afsat på et objektglas, efter at den passerede gennem monolit-processen. De udførte enkeltcellet Raman-analyse ved manuelt at scanne den optiske probe på tværs af prøven. De forventer brugen af selektiv lyseringsteknologi, koblet til konfokal Raman-mikroskopi i fremtiden for at forbedre processen med at detektere bakteriestammer af interesse ved lave koncentrationer på et defineret sted af interesse.
På denne måde Jung Y. Han og hans kolleger udviklede en mikrofluidisk monolit til effektivt at isolere intakte bakterier med vidtgående termanostik, point-of-care potentiale til kliniske anvendelser. De forestiller sig foreningen af konfokale Raman-mikroskopiværktøjer, der i øjeblikket stort set er begrænset til forskningslaboratoriet med nye miniaturiserede og håndholdte systemer for at bane vejen mod hurtige og bærbare point-of-care-enheder.
© 2019 Science X Network
Sidste artikelFå mere varme ud af sollys
Næste artikelSort (nano)guld til at bekæmpe klimaændringer
 Varme artikler
Varme artikler
-
 Indlejrede stænger:Chitin-siliciumdioxid nanokomposit fremstillet ved selvorganisering og sol-gel k…(PhysOrg.com) -- Selvorganiseringsprocesser, der involverer kemiske byggesten, er grundlaget for mange biologiske processer og er i stigende grad af interesse inden for materialesyntese, for eksempel
Indlejrede stænger:Chitin-siliciumdioxid nanokomposit fremstillet ved selvorganisering og sol-gel k…(PhysOrg.com) -- Selvorganiseringsprocesser, der involverer kemiske byggesten, er grundlaget for mange biologiske processer og er i stigende grad af interesse inden for materialesyntese, for eksempel -
 Rene carbon nanorør med suveræne egenskaber1000 enkelt nanorør transistorer på en chip. Kredit:Aalto University Single-wall carbon nanorør (SWCNT) har fundet mange anvendelser i elektronik og nye berøringsskærmenheder. Carbon nanorør er pl
Rene carbon nanorør med suveræne egenskaber1000 enkelt nanorør transistorer på en chip. Kredit:Aalto University Single-wall carbon nanorør (SWCNT) har fundet mange anvendelser i elektronik og nye berøringsskærmenheder. Carbon nanorør er pl -
 Nittegrafen beviser sin evne:Hærdet materiale er lettere at håndtere, nyttig til elektronikNittegrafen (markeret i gult) er næsten lige så gennemsigtig som ren grafen og bevarer sin styrke og ledningsevne, selv når den bøjes. Materialet blev skabt på Rice University. Kredit:Tour Group/Rice
Nittegrafen beviser sin evne:Hærdet materiale er lettere at håndtere, nyttig til elektronikNittegrafen (markeret i gult) er næsten lige så gennemsigtig som ren grafen og bevarer sin styrke og ledningsevne, selv når den bøjes. Materialet blev skabt på Rice University. Kredit:Tour Group/Rice -
 Forskere producerer grafen nanobånd med nanoporer til hurtig DNA-sekventeringEn illustration af en elektronstråle, der borer en hakformet nanopore i et grafen nanobånd. Instruktionerne til opbygning af alle kroppens proteiner er indeholdt i en persons DNA, en række kemikal
Forskere producerer grafen nanobånd med nanoporer til hurtig DNA-sekventeringEn illustration af en elektronstråle, der borer en hakformet nanopore i et grafen nanobånd. Instruktionerne til opbygning af alle kroppens proteiner er indeholdt i en persons DNA, en række kemikal
- Puget Sound-hvaler får en pause fra sejlere uden tab for hvalsafari
- Kvantekrypteringsnøgler til sikker kommunikation distribueret 1, 000 kilometer længere end tidlige…
- Opmærksomhed FN:Lad dig ikke narre af Australias seneste rapport om Great Barrier Reef
- Sintring af atomisk tynde materialer med keramik nu muligt
- Hvordan (og hvorfor) lægge vægt på lytning i effektiv klimakommunikation
- Topologisk superledende fase beskyttet af 1-D lokale magnetiske symmetrier


