En switch, der regulerer trafikken på tværs af blodkar
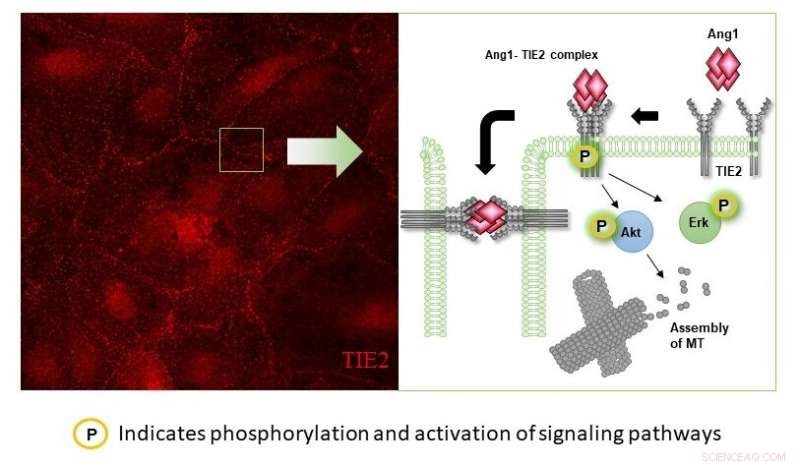
Foreslået mekanisme af Angiopoetin-1 (Ang-1) induceret anti-permeabilitetseffekt i humane mikrovaskulære endotelceller. Billedet til venstre viser blodkarceller, der er farvet for at identificere placeringen af proteinet TIE2. Når aktivatoren Angiopoeitin-1 (Ang-1) påføres, TIE2 er lokaliseret nær celleoverfladen, hvor Ang1-Tie2 danner en bro, der holder celler sammen. I efterfølgende forsøg, det er påvist, at Ang1-binding kunne mediere cellulære ændringer ved at øge enten phosphorylering af Akt eller Erk, som derefter hjælper med at stabilisere mikrotubulierne for at opretholde cellulær struktur. Kredit:National University of Singapore
NUS-forskere har opdaget en kontrolmekanisme, der regulerer trafikken af celler og stoffer på tværs af blodkar. Denne effekt kan have betydelig indflydelse på kræftmetastaser.
Nanopartikler bliver brugt i forskellige biomedicinske applikationer, herunder diagnosticering og behandling af kræft. Lægemiddelfrigivende nanopartikler kunne programmeres til at afgive lægemidler lokalt på tumorstedet. Imidlertid, nyere undersøgelser har vist, at disse nanopartikler kan føre til dannelsen af mikrometerstore huller i væggene i blodkarrene, gør dem "utætte". Hos kræftpatienter, disse huller kunne gøre det nemmere for overlevende kræftceller at flygte fra deres primære steder til andre dele af kroppen.
Et forskerhold bestående af prof HO Han Kiat fra Institut for Farmaci, NUS og professor David LEONG fra Institut for Kemi og Biomolekylær Teknik, NUS opdagede, at Angiopoetin-1 (en type protein) kan hjælpe med at lukke hullerne i blodkarrene forårsaget af nanopartikler og reducere deres permeabilitet. Det her, på tur, styrer passagen af stoffer og molekyler gennem blodkarrenes vægge. Ved at justere mængden af Angiopoetin-1 i kroppen, forskerne fandt ud af, at de kan begrænse og vende den "lækage" induceret i blodkar forårsaget af nanopartikler i biomedicinske applikationer.
I deres eksperimenter, forskerholdet administrerede brystkræftceller under huden på murine modeller og introducerede derefter titaniumdioxid-nanopartikler i deres blodkar. De konstaterede, at nanopartiklerne øgede lækagen af kræftceller ind i blodkarrene. Denne lækageeffekt kan øge bevægelsen af cirkulerende kræftceller til fjerne væv, hvilket kan resultere i dannelsen af nye sekundære kræftsteder, som tidligere ikke var tilgængelige for kræftcellerne.
Følger op på dette, holdet fandt ud af, at Angiopoeitin-1 fungerer som en vækstfaktor for TIE2, en celleoverfladeregulator, der findes naturligt i vores blodkar. Når der er flere Angiopoetin-1, TIE2-protein er lokaliseret og stimuleret til at lukke hullerne i blodkarrene, som kan være forårsaget af nanopartiklerne. Dette reducerer igen permeabiliteten af blodkarrene og begrænser mængden af kræftceller, der lækker ind i blodbanen.
Prof Ho sagde, "Undersøgelsen viste, at Angiopoetin-1 potentielt kunne bruges som en modmekanisme til at begrænse og vende den lækage, der induceres af nanopartikler. Dette hjælper med at mindske ekstravasationen og transporten af kræftceller til andre væv hos kræftpatienter."
 Varme artikler
Varme artikler
-
 Topografiske metoder til måling af grafentykkelseEt EFM -fasebillede, der viser et lag grafen (1LG) og grænsefladelaget (IFL). (Phys.org) - Grafen har længe vist potentiale for brug inden for elektronik, men vanskeligheder med at producere mater
Topografiske metoder til måling af grafentykkelseEt EFM -fasebillede, der viser et lag grafen (1LG) og grænsefladelaget (IFL). (Phys.org) - Grafen har længe vist potentiale for brug inden for elektronik, men vanskeligheder med at producere mater -
 Air Force Center of Excellence tildelt i nanostrukturer og forbedret kognitionKenneth Sandhage, meddirektør for BIONIC Center of Excellence, designer, fremstilling, karakterisering og modellering af ydeevnen af uorganiske/organiske nanokompositter for effektiv, fjerntliggende
Air Force Center of Excellence tildelt i nanostrukturer og forbedret kognitionKenneth Sandhage, meddirektør for BIONIC Center of Excellence, designer, fremstilling, karakterisering og modellering af ydeevnen af uorganiske/organiske nanokompositter for effektiv, fjerntliggende -
 Forskere opdager, at form betyder noget i DNA-nanopartikelterapiDenne illustration viser DNA-molekyler (lysegrøn), pakket ind i nanopartikler ved at bruge en polymer med to forskellige segmenter. Et segment (blågrønt) bærer en positiv ladning, der binder det til D
Forskere opdager, at form betyder noget i DNA-nanopartikelterapiDenne illustration viser DNA-molekyler (lysegrøn), pakket ind i nanopartikler ved at bruge en polymer med to forskellige segmenter. Et segment (blågrønt) bærer en positiv ladning, der binder det til D -
 Lama nanobodies kan være nøglen til at forhindre dødelig post-transplantation infektionFig. 1:VUN100bv binder og hæmmer US28-signalering. -en ELISA-binding af monovalent VUN100 og bivalent VUN100bv til membranekstrakter af US28-udtrykkende HEK293T-celler. Repræsentativ figur af tre ua
Lama nanobodies kan være nøglen til at forhindre dødelig post-transplantation infektionFig. 1:VUN100bv binder og hæmmer US28-signalering. -en ELISA-binding af monovalent VUN100 og bivalent VUN100bv til membranekstrakter af US28-udtrykkende HEK293T-celler. Repræsentativ figur af tre ua
- Skub stjernekiggeri til det yderste med verdens største gamma-observatorium
- Solbeskyttelse uden persienner
- Forskere når hellig gral i etiketfri kræftmarkørdetektion:Enkeltmolekyler
- Ryanair giver lavere priser skylden for en ny profitadvarsel
- Når det kommer til rapportering om seksuelle overgreb i medierne, ord betyder noget
- Jordens ilt steg i gradvise trin frem for store udbrud


