Struktur af protein nanoturbin afsløret

Hver proteinunderenhed er af forskellig farve. V1 domæne er top, Vo nederst, perifere stilke venstre og højre. Baggrunden viser vinddrevet vandpumpe. Kredit:IST Østrig, 2019
Celler er afhængige af proteinkomplekser kendt som ATP-syntaser eller ATPaser for deres energibehov. Adenosintrifosfat (ATP) molekyler driver de fleste af de processer, der opretholder liv. Strukturbiolog professor Leonid Sazanov og hans forskningsgruppe fra Institut for Videnskab og Teknologi Østrig (IST Østrig) i Klosterneuburg, Østrig har nu bestemt den første atomare struktur af repræsentanten for V/A-ATPase-familien, udfylde hullet i det evolutionære træ i disse essentielle molekylære maskiner. Disse resultater opnået ved hjælp af de nyeste kryo-elektronmikroskopimetoder afslørede en turbine eller vandmølle lignende struktur af enzymet og er nu blevet offentliggjort i tidsskriftet Videnskab .
Roterende kraft
ATP-syntaser/ATPaser er store membranproteinkomplekser, som deler overordnede bruttobygningsplaner og roterende katalysemekanismer. Denne proteinfamilie inkluderer F-type enzym fundet i mitokondrier (cellekraftfabrikker), kloroplaster (organeller, der udfører fotosyntese i planter) og bakterier; V (vakuolær)-type fundet i intracellulære rum i eukaryoter (højere organismer med en kerne) og A (arkæal)-type fundet i prokaryoter - archaea (gamle mikroorganismer) og nogle bakterier.
Forskellige smagsvarianter af ATPaser
F- og A-type enzymer fungerer normalt til at producere ATP, drevet af protonstrøm over membranen. V-type enzymer virker normalt omvendt, bruge ATP til at pumpe protoner. V- og A-ATPaser ligner strukturelt, men de adskiller sig fra F-typen ved at have to eller tre perifere stilke og yderligere forbindende proteinunderenheder mellem V1 og Vo. V-type enzymer udviklede sig sandsynligvis fra A-typen og på grund af disse ligheder kaldes A-type også V/A-ATPase. Nogle bakterier, inklusive Thermus thermophilus , erhvervet et A-type enzym. Long Zhou, postdoc i Sazanov forskningsgruppen i IST Østrig, har oprenset og undersøgt dette enzym (ThV1Vo) ved cryo-EM. I modsætning til F-type, for V-type ATPaser blev kun strukturerne af de isolerede V1- og Vo-domæner bestemt tidligere. Hvordan V1 er koblet til Vo var derfor ikke kendt, og viden om den fulde katalytiske cyklus manglede.
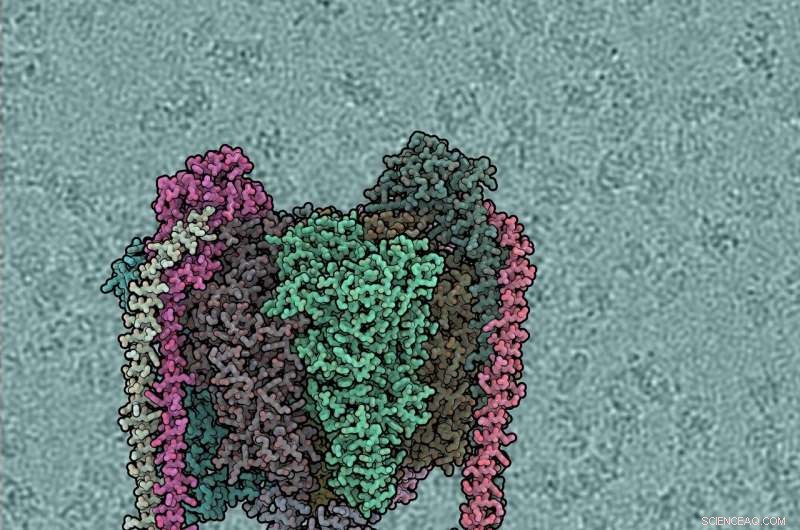
Hver proteinunderenhed er af forskellig farve. V1 domæne er top, Vo nederst, perifere stilke venstre og højre. Baggrunden viser råt kryo-EM mikrofotografi, med individuelle ATPase-molekyler synlige. Kredit:IST Østrig, 2019
Plasticitet og konkurrence
Forskerne bestemte ikke én, men i alt fem strukturer af hele ThV1Vo enzymet, ved hjælp af kryo-elektronmikroskopi metoder udviklet for nylig i den såkaldte "resolution revolution" af denne teknik. Strukturerne repræsenterer flere konformationelle tilstande af enzymet, der adskiller sig efter rotorens position inde i statoren. Global konformationel plasticitet af ThV1Vo afsløres som væsentlig V1, der vakler i rummet i overgangen fra en tilstand til en anden. Det er et resultat af mekanisk konkurrence mellem rotation af den bøjede centrale rotor og statorens stivhed. V1-Vo kobling opnås via tæt strukturel og elektrostatisk match mellem akslen og den V-type specifikke underenhed, der forbinder den med c-ringen. Visualiseringen af protonbanen afslørede signifikante forskelle i fordelingen af ladede proteinrester fra den i F-ATPaser, med et strengere "checkpoint", der forhindrer "glidning" af enzymet.
Hvorfor yderligere kompleksitet?
I stedet for en enkelt perifer stilk af F-type enzymer, A-typer såsom ThV1Vo har to perifere stilke, mens eukaryote V-typer har tre. Men hvad er fordelen ved den ekstra kompleksitet i den allerede meget store proteinsamling, sammen med yderligere underenheder, der forbinder V1 og Vo? F1/V1-domænet har en tredobbelt symmetri, og derfor produceres (eller forbruges) ét ATP-molekyle for hver 120° rotation af statoren inde i F1/V1. Professor Leonid Sazanov siger:"I V/A-ATPases er dette trin en engangs 120° rotation, i modsætning til F-ATP syntase hvor den er opdelt i flere undertrin. Dermed, større plasticitet kan være påkrævet i ThV1Vo for at forbinde disse 120° trin i V1 til mindre pr. c underenhedstrin i Vo c12-ringen. Denne yderligere fleksibilitet kan gives i V-typer af de yderligere perifere stilke og forbindende underenheder. Vores nye strukturer viser, hvordan dette opnås, giver en ramme for hele V-ATPase-familien".
Sidste artikelNanotermometer måler temperaturen inde i cellerne
Næste artikelGennembrud set inden for kunstig øjen- og muskelteknologi
 Varme artikler
Varme artikler
-
 Glitter fra sølv lyser op Alzheimers mørke hemmelighederBilledet viser giftige Alzheimers amyloid beta-molekyler, der lander på en falsk cellemembran, viklet om en sølv nanopartikel. En laser, med hjælp fra sølvpartiklen, lyser molekylet op for at afsløre
Glitter fra sølv lyser op Alzheimers mørke hemmelighederBilledet viser giftige Alzheimers amyloid beta-molekyler, der lander på en falsk cellemembran, viklet om en sølv nanopartikel. En laser, med hjælp fra sølvpartiklen, lyser molekylet op for at afsløre -
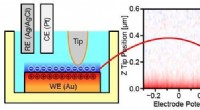 Billeddannelse af akkumulerede ladninger ved fast-elektrolyt-grænsefladerLadningsakkumuleringsadfærd ved Au-elektrolytgrænsefladen blev visualiseret ved tredimensionel åben-loop elektrisk potentialmikroskopi med varierende elektrodepotentiale. Kredit:Kanazawa University
Billeddannelse af akkumulerede ladninger ved fast-elektrolyt-grænsefladerLadningsakkumuleringsadfærd ved Au-elektrolytgrænsefladen blev visualiseret ved tredimensionel åben-loop elektrisk potentialmikroskopi med varierende elektrodepotentiale. Kredit:Kanazawa University -
 Forskning viser, at grafen danner elektrisk ladede rynkerStabler af grafen har en tendens til at danne savtandskrukker, når de komprimeres. Disse rynker har en elektrisk ladning, der kunne være nyttig til at studere DNA eller vejlede selvsamling på nanoskal
Forskning viser, at grafen danner elektrisk ladede rynkerStabler af grafen har en tendens til at danne savtandskrukker, når de komprimeres. Disse rynker har en elektrisk ladning, der kunne være nyttig til at studere DNA eller vejlede selvsamling på nanoskal -
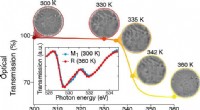 Isolator-metal overgang på nanoskalaFaseovergang fra isolator til metallisk fase i VO2 som funktion af temperaturen. Kredit:ICFO Styring af strømmen af elektroner i kredsløb opnås gennem passende valg af materialer. Metaller tilla
Isolator-metal overgang på nanoskalaFaseovergang fra isolator til metallisk fase i VO2 som funktion af temperaturen. Kredit:ICFO Styring af strømmen af elektroner i kredsløb opnås gennem passende valg af materialer. Metaller tilla
- Nanorør defekter lige bedre energi og lagringssystemer
- Sprængfyldt med stjernefødsel
- Forskere skaber nye mikropartikler, der selv samler sig som atomer til molekyler
- Sådan beregnes diameter til firkantet føde
- NASAs seneste exoplanetplakater er en Halloween-forkælelse
- Hvordan i alverden fryser et vandfald?


