Guld-DNA nanosolsikker til effektiv gendæmpning og kontrolleret transformation
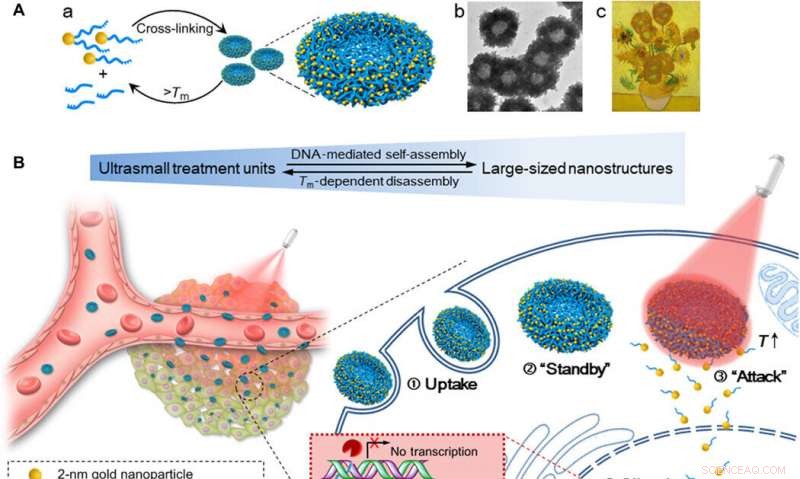
Ordning af selvsamlede guld-DNA nanosolsikker for øget cellulær optagelsesmængde, afstembar gendæmpningseffektivitet, og kontrolleret tumorhæmmende virkning ved NIR-bestråling. (A) (a) Montering og demontering af den store nanostruktur (200-nm guld-DNA nanosolsikker) fra/til ultrasmå nanopartikler (2-nm Au-POY2T NP'er). (b) Repræsentativt TEM-billede af nanosolsikkerne. (c) Mesterværk:Solsikker (Vincent van Gogh, 1889). (B) Venstre:In vivo tumorretention og penetration af transformerbare nanosolsikker. Til højre:Forbedret cellulær optagelse og kontrolleret onkogen-dæmpningsproces af nanosolsikker in vitro. ① Nanosolsikker i store størrelser blev optaget af en MCF-7-celle. ② Nanosolsikkerne standby i cellens cytoplasma. ③ Ved NIR-bestråling, store guld-DNA nanostrukturer adskiller og frigiver små enheder (2-nm Au-POY2T NP'er) for at angribe cellekernen. ④ Silencing-sekvensen POY2T vil binde til P2-promotoren af c-myc-onkogenet og nedregulere c-myc-ekspressionen af MCF-7-celler, som kan styres (ON/OFF) og reguleres (Lav/Medium/Høj) af NIR-bestrålingen. Kredit: Videnskabens fremskridt , doi:10.1126/sciadv.aaw6264
Udvikling af et effektivt leveringssystem til forbedret og kontrolleret geninterferensbaseret terapi er en eksisterende udfordring inden for molekylærbiologi. Det fremadskridende område for nanoteknologi kan give en effektiv, tværfaglig strategi for at lette nukleinsyrelevering. I en ny rapport, Shuaidong Huo og kolleger i de tværfaglige afdelinger for nanovidenskab, Interaktive materialer, Kemi og polymerforskning i Kina, Tyskland og USA brugte triplex-dannende oligonukleotidsekvenser koblet til dens komplementære streng for at mediere selvsamlingen af ultrasmå guld-nanopartikler.
De resulterende solsikkelignende nanostrukturer viste stærk nær infrarød (NIR) absorption og evne til fototermisk omdannelse. Da forskerne bestrålede strukturerne med NIR, de større nanostrukturer adskilt for at generere ultrasmå nanopartikler modificeret med c-Myc onkogensekvensen for direkte at målrette cancercellekernen. Huo et al. kontrolleret gendæmpning ved synergistisk at kontrollere tidspunktet for præinkubering af celler med nanopartikler sammen med nanostruktur-selvsamling (in vitro og in vivo) og tidsrammen for NIR-bestråling. Undersøgelsen gav et nyt paradigme til at konstruere effektive og skræddersyede nanobærere til anvendelser af geninterferens og terapeutisk genlevering.
Genterapi har et stort potentiale til at behandle en række sygdomme og komplikationer, herunder infertilitet, HIV og kræft. Succesfuld genterapi til at lindre sygdomssymptomer afhænger af en effektiv genleveringsvehikel eller vektor. Under processen, genbæreren skal krydse mange biologiske barrierer og cellemembraner, mens den undslipper endosomal indeslutning og nuklease-baseret nedbrydning. Sammenlignet med virusbaserede leveringsstrategier, ikke-virale genleveringstilgange står over for mange udfordringer under processen med at indlæse og frigive DNA/RNA, målrettet levering og intracellulær optagelse, inklusive uforligelighed i forhold til immunresponser in vivo.
Kraftige bestræbelser inden for nanoteknologi er i gang for at konstruere stabile og effektive vehikler til genoverførsel til kræftceller. På grund af deres unikke fysisk-kemiske egenskaber er der opstået en række nanomaterialer til genlevering. Blandt dem, guld nanopartikler (Au NP'er) med specifik størrelse og overfladeegenskaber kan overvinde hindringer in vivo for at blive et af de mest undersøgte genbærersystemer. Imidlertid, disse strategier er stødt på en række mangler, og derfor er det vigtigt at etablere effektive leveringssystemer eller forbedrede og kontrollerede genterapier.
Selvmontering og test af solsikkelignende nanostrukturer
I nærværende arbejde, Huo et al. var inspireret af naturens evne til at hybridisere DNA ved konstruktion af DNA-medieret, selvsamlede guld DNA nanostrukturer (ca. 200 nm). Det solsikkelignende design viste stærk NIR-absorption og fototermiske omdannelsesegenskaber. Ved NIR-bestråling, strukturerne adskilt for at frigøre ultrasmå guldnanopartikler (2 nm, Au NP'er) med potentiale for onkogen-dæmpning, forbedret celle- og cellekernepermeabilitet og forbedret transfektionseffektivitet. Forskerne kontrollerede synergistisk celle-nanomateriale-interaktionerne baseret på tidspunktet for præ-inkubation i laboratoriet, efterfulgt af tidspunktet for cirkulation in vivo og tidslinjen for bestråling. Forsøgene lettede øget cellulær optagelse, afstembar gendæmpningseffektivitet og kontrolleret tumorhæmning. De transformerbare nanosolsikker gav en fremragende model til at designe nanovehicles til lægemiddellevering med stort potentiale inden for biomedicin.
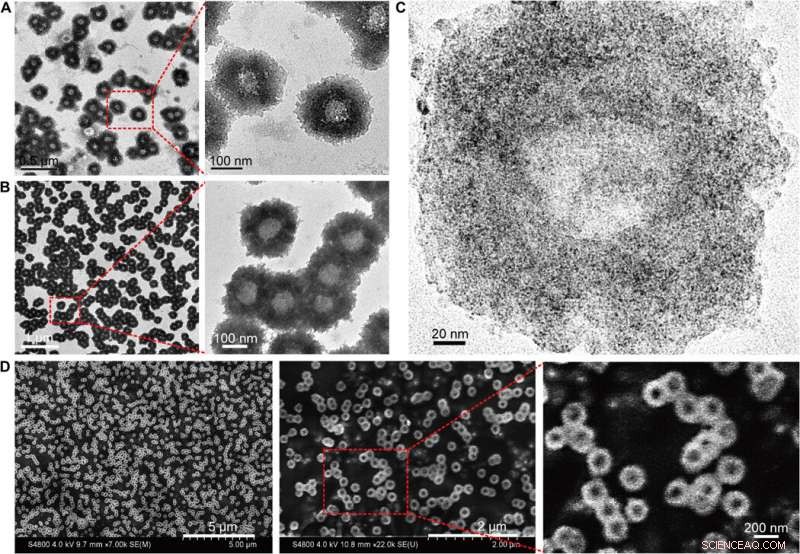
Morfologisk karakterisering af de selvsamlede nanostrukturer (nanosolsikker). (A) TEM (200 kV) billeder af nanosolsikker med forstørrede strukturelle detaljer. (B) Bio-TEM (80 kV) billeder med forstørrede polymer strukturelle detaljer. (C) Højopløselige TEM (200 kV) billeder, der viser fordelingen af ultrasmå NP'er på den selvmonterede nanostruktur. (D) SEM-billeder med forstørret overfladetopografi af nanosolsikkerne. Kredit:Science Advances, doi:10.1126/sciadv.aaw6264
Huo et al. syntetiserede først de to-nanometer Au NP'er coatet med tiopronin og modificerede dem med thiol-oligonukleotider (SH-POY2T) ved hjælp af en etableret metode til ligandudveksling. 23-nukleotid (nt) POY2T-oligonukleotid bandt P2-promotoren af c-myc-onkogenet for at danne en tripleksstruktur og nedregulere onkogen c-myc-ekspression. Parallelt, de designede og syntetiserede en anden enkeltstrenget sekvens kendt som CA til komplementært at hybridisere til halen af POY2T-sekvensen og blokere dens binding til c-myc-onkogenet. Ved afslutning, nanostrukturen selvsamlet til solsikkelignende strukturer. Holdet undersøgte nanostrukturen (200 nm) ved hjælp af transmissionselektronmikroskopi (TEM). Yderligere billeddannelse afslørede yderligere detaljer om DNA-delene af "solsikke"-strukturen. Da materialeforskerne brugte scanningselektronmikroskopi (SEM) til at validere TEM-resultaterne, de observerede overensstemmelse mellem metoderne.
De undersøgte UV-Vis-absorptionsspektrene for de ultrasmå Au NP'er før DNA-medieret selvsamling. De monodispergerede, individuelle to-nanometer Au-POY2T NP'er viste stærk absorption i NIR-regionen for at generere varme under NIR-bestråling. Huo et al. krediterede den observerede stærke NIR-absorbans til tæt interpartikelafstand og uensartet rumlig fordeling af individuelle NP'er inden for den større nanostruktur. De testede varmeresponsen af de selvsamlede nanostrukturer under NIR-bestråling og noterede smeltepunktet for de komplementære DNA-sekvenser (POY2T og CA) til omtrent 41 grader C, at dissociere halvdelen af dupleksstrukturen mellem komplementære DNA-sekvenser. Huo et al. valgt 10 minutter som det optimale tidspunkt for NIR-bestråling i undersøgelsen.
Fototermisk egenskab og demonteringsadfærdsundersøgelse af de selvsamlede nanostrukturer. (A) Synlige absorptionsspektre af 2-nm kernestørrelse NP'er og 200-nm selvsamlede nanostrukturer. a.u., absorbans enhed. (B) Temperaturrespons af selvsamlede nanostrukturer, ved NIR-bestråling, dispergeret i vand og cellekulturmedium. Middelværdier ± SD, n =3. (C) Temperaturstigning af selvsamlede nanostrukturer, ved NIR-bestråling, dispergeret i vand og cellekulturmedium. (D) Ændring af maksimal absorbans (767 nm) af 2-nm kernestørrelse NP'er og 200 nm selvsamlede nanostrukturer ved NIR-bestråling. (E og F) TEM-observation af adskillelsesadfærd af 200 nm selvsamlede nanostrukturer før (øverst) og efter (nederst) NIR-bestråling (808 nm, 10 min). (G) Hydrodynamisk diameter af (a) monodisperse 2-nm Au-POY2T NP'er og størrelsesændring af 200-nm nanosolsikker før (b) og efter (c og d) NIR-bestråling i forskellige tidsperioder (3 og 10 min). Kredit:Science Advances, doi:10.1126/sciadv.aaw6264 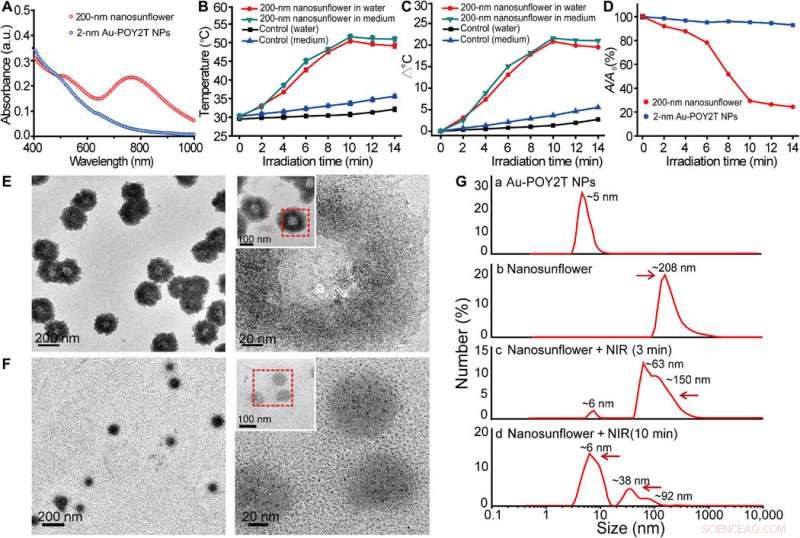
Forskerne antog, at de selvmonterede nanostrukturer ville krympe og adskilles til individuelle ultrasmå Au-POY2T NP'er. Efter 10 minutters NIR-bestråling, den maksimale absorption (767 nm) af nanostrukturer faldt markant for at adskille solsikkestrukturen. De fulgte eksperimenterne før og efter NIR-bestråling med TEM-observationer og brugte partikelstørrelsesanalysatorer til at forstå demonteringsprocessen og størrelsestransformationen af nanostrukturerne op til seks nanometer i størrelse og bekræftede den optimale egnethed af 10-minutters tidslinje.
Huo et al. anvendte NIR-bestråling på MCF-7-celler behandlet med selvsamlede guld-DNA-nanostrukturer og testede deres cellulære optagelse in vitro som proof-of-concept. De bestemte den cellulære internalisering af Au-POY2T (2 nm) på tværs af forskellige inkubationstider og kvantificerede deres cellulære optagelse ved hjælp af induktivt koblet plasmamassespektroskopi (ICP-MS) og tidligere metoder. De bemærkede øget internalisering efter seks timers inkubation sammenlignet med 24-timers inkubationstidslinjer. De observerede ikke inhibitorer af endocytose for at påvirke Au-POY2T NP-optagelsen, foreslår involvering af en alternativ vej såsom membranfusion.
Forståelse af gendæmpningsadfærd af de selvsamlede nanostrukturer
Kontrolleret kernelokalisering og gendæmpningsundersøgelse in vitro af de selvsamlede nanostrukturer. (A) Skematisk af in vitro-celleforsøgsopsætningen for den kontrollerede NP-kernelokalisering og genreguleringsundersøgelse. (B) Antal 2-nm Au-POY2T NP'er lokaliseret i MCF-7 cellekernen med behandling af ① individuelle 2-nm Au-POY2T NP'er, ② 200-nm nanosolsikker, og 200-nm nanosolsikker med NIR-bestråling (10 min) efter forskellige præinkubationstider (③ 1, ④ 3, ⑤ 6, og ⑥ 12 timer). Middelværdier ± SD, n =3. Statistiske forskelle blev bestemt ved tosidet Students t-test; *P <0,05 og **P <0,01. (C) Konfokal observation af distribution af fluorescein-isothiocyanat-mærkede nanosolsikker (grønne) før (øverst) og efter (nederst) NIR-bestråling i MCF-7-celler. Nucleus blev mærket med 4′, 6-diamidino-2-phenylindol (blå). (D) Bio-TEM billede af lokaliseringen af store nanosolsikker (øverst, rød pil) i cytoplasmaet og fordeling af frigivne små NP'er (nederst, blå pil) i cytoplasma og kerne efter NIR-bestråling i MCF-7-celler. (E) Cytotoksicitetsevaluering af MCF-7-celler med behandling af 200 nm nanosolsikker efter NIR-bestråling (efter en periode med præinkubationstid:1, 3, 6, og 12 timer, henholdsvis) sammenlignet med kontrol, 2-nm Au-TIOP NP'er, POY2T sekvens, CA sekvens, 2-nm Au-POY2T NP'er, 200-nm nanosolsikker uden NIR-bestråling, og kun NIR-eksponering. Alle koncentrationer af behandlinger var på eller lig med 1 μM i POY2T-sekvens og blev testet efter i alt 24 timers inkubation. Middelværdier ± SD, n =3. Statistiske forskelle blev sammenlignet med behandlingsgruppen af ① individuelle 2-nm Au-POY2T NP'er bestemt ved to-halet Student's t-test; *P <0,05 og **P <0,01. (F) C-myc mRNA-niveau bestemt ved real-time PCR efter forskellige behandlinger som beskrevet ovenfor. Middelværdier ± SD, n =3. Statistiske forskelle blev bestemt ved tosidet Students t-test; **P <0,01 og ***P <0,001. (G) C-myc-proteinniveauer bestemt ved Western blot og (H) tilsvarende kvantitativt histogram efter forskellige behandlinger som beskrevet ovenfor. GAPDH, glyceraldehydphosphatdehydrogenase. Kredit:Science Advances, doi:10.1126/sciadv.aaw6264
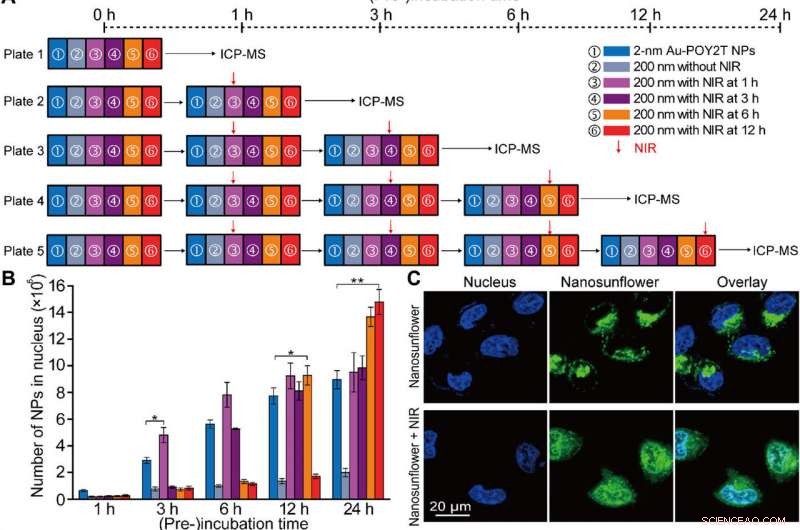
Efter forbedret cellulær optagelse af selvsamlede nanostrukturer in vitro, forskerholdet undersøgte fordelingen af nanopartikler i cellekernerne ved hjælp af "standby" og "angrebs"-strategier efter NIR-udløsning. For det, de udtog cellekerner efter inkubation, til ICP-MS-analyse efter NIR-bestråling på tværs af forskellige inkubationsperioder (en, tre, seks og 12 timer). De bemærkede, at præ-inkubationsperioden i høj grad påvirker nanopartikel-internalisering i cellekernen, og forskerne regulerede Au-POY2T NP'er i cellekernen baseret på tidspunktet for præ-inkubation og NIR-bestråling.
Huo et al. undersøgte også NIR-bestrålingskontrollerede terapeutiske virkninger af nanosolsikker ved hjælp af cellelevedygtighedstests; de observerede, at onkogen-dæmpning steg markant (80 procent) og dræbte flere kræftceller. Forskerholdet kontrollerede den terapeutiske virkning effektivt ved at ændre tidslinjen for præinkubation og bestråling effektivt. Resultaterne understøttede en overlegen evne hos de transformerbare nanosolsikker til at dæmpe c-myc-onkogenet og oncoproteinet. Forskerne kontrollerede gendæmpningsprocessen ved at indstille præ-inkubationstidslinjer før NIR-bestråling.
Kontrol af hæmning af tumorvækst ved hjælp af selvsamlede nanosolsikker
For at teste den kontrollerbare anti-tumor effektivitet af nanosolsikker in vivo, forskerne undersøgte først deres blodkompatibilitet for at bekræfte god blodbiokompatibilitet. Forskerholdet etablerede derefter MCF-7 tumormodellen ved hjælp af BALB/c nøgne mus, tillod tumorvolumenerne at nå 50 mm 3 og tilfældigt inddelte dyrene i ni grupper og behandlede dem med 1000 µl varierende POY2T-formuleringer. Efter hver injektion, de bestrålede dyregrupperne med NIR-lasere i 10 minutter for at nå en lokal temperatur over 41 grader C.
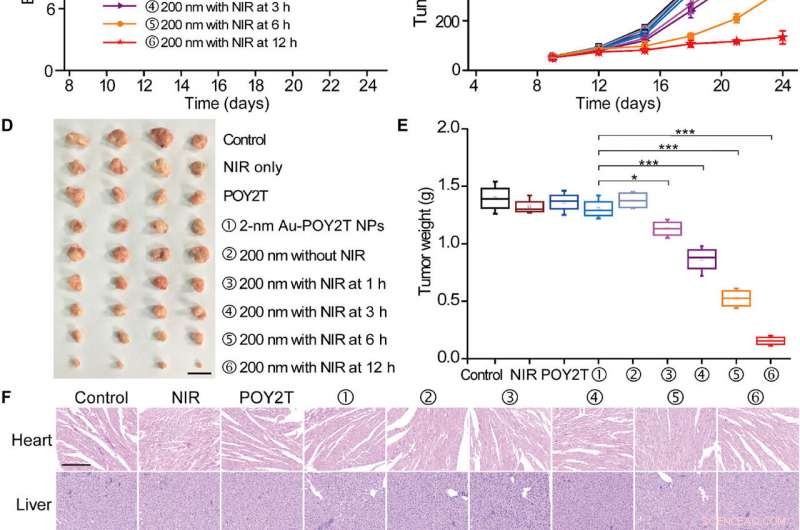
Kontrolleret tumorvækstinhiberingsundersøgelse af de selvsamlede nanostrukturer. (A) MCF-7 tumor BALB/c nøgne musemodel blev etableret på dag 0. Efter tumorer var klar, musene blev tilfældigt opdelt i ni grupper og behandlet med 100 μl af forskellige formuleringer (svarende til 10 μM i POY2T-sekvens; gruppe ① med 2-nm Au-POY2T NP'er og grupper ②, ③, ④, ⑤, og ⑥ med 200 nm nanosolsikker) på dag 9, 12, og 15. I grupper ③, ④, ⑤, og ⑥, tumorerne blev bestrålet med en NIR-laser i 10 minutter ved 1, 3, 6, og 12 timer efter hver intravenøs injektion. saltvand, Kun NIR, og POY2T blev brugt som kontrolgrupper. (B) kropsvægte og (C) tumorvolumener blev målt hver 3. dag. Målestok, 1 cm. Efter at musene var blevet aflivet på dag 24, alle tumorer blev (D) isoleret og (E) vægtet, henholdsvis. Middelværdier ± SD, n =4. Statistiske forskelle blev bestemt ved tosidet Students t-test; *P <0,05, **P <0,01, og ***P <0,001. (Fotokredit:Ningqiang Gong, Nationalt Center for Nanovidenskab og Teknologi, Kina.) (F) Hæmatoxylin- og eosinfarvningsbilleder af organer, herunder hjertet, lever, milt, lunge, nyre, og tumor efter forskellige behandlinger. Målestok, 200 μm. Kredit:Science Advances, doi:10.1126/sciadv.aaw6264
Bemærk, mus behandlet med den nanosolsikke-behandlede gruppe og bestrålet efter 12 timer viste de mest signifikante antitumoreffekter, hvilket indikerer effektiv levering af gendæmpende enheder til tumorstedet. Efter 24 dage, Huo et al. ofrede dyrene, isolerede tumorerne og vejede dem for at demonstrere nanosolsikkebaseret NIR-kontrolleret tumorvækstinhibering in vivo. Baseret på histologiske undersøgelser, holdet viste, at behandlingen signifikant reducerede tumorvækst og ikke påvirkede morfologien af andre organer. Resultaterne bekræftede den terapeutiske effektivitet og mangel på bivirkninger for nanosolsikker og NIR-terapi.
På denne måde Shuaidong Huo og kolleger designet, udviklet og optimeret nanoagenter til effektiv antitumorterapi. De konstruerede selvsamlede solsikkelignende nanostrukturer til at fungere som multipartikelbærere fyldt med mange ultrasmå terapeutiske enheder. Ved NIR-bestråling, nanostrukturerne dissocierede for at frigive sværme af små NP'er for at målrette cellekernen. Hos tumorbærende mus, de store solsikker målrettede passivt mod tumorstedet efterfulgt af NIR-bestråling for at transformere den genetiske tumorsammensætning og krympe den. Forskerholdet sigter mod at forbedre transfektionseffektiviteten og tilvejebringe en plan for kontrollerbar gendæmpning på tumorsteder ved hjælp af transformerbare geninterferensbærere til indviklede terapeutiske forhold på niveauet af den enkelte celle.
© 2019 Science X Network
 Varme artikler
Varme artikler
-
 Kobber -nanotråde Aktiver bøjelige skærme, SolcellerSmå kobbertråde kan bygges i løs vægt og derefter printes på en overflade for at lede strøm, gennemsigtigt. Benjamin Wiley, Duke Chemistry (PhysOrg.com) - Et team af kemikere fra Duke University h
Kobber -nanotråde Aktiver bøjelige skærme, SolcellerSmå kobbertråde kan bygges i løs vægt og derefter printes på en overflade for at lede strøm, gennemsigtigt. Benjamin Wiley, Duke Chemistry (PhysOrg.com) - Et team af kemikere fra Duke University h -
 Lille opdagelse har et stort løfte om kræft -nanoteknologiZohre Gorunmez, en fjerdeårs ph.d.-studerende ved University of Cincinnati, gennemfører næsten tre års komplekse beregninger for bedre at forstå en ny SERS -nanotag opdaget af forskere ved UC. Da
Lille opdagelse har et stort løfte om kræft -nanoteknologiZohre Gorunmez, en fjerdeårs ph.d.-studerende ved University of Cincinnati, gennemfører næsten tre års komplekse beregninger for bedre at forstå en ny SERS -nanotag opdaget af forskere ved UC. Da -
 Blinkede nanodiamanter er kun en fase, forskerholdet finderEt transmissionselektronmikroskopbillede viser et nanodiamantgitter. Rice University kemikere brugte deres flash Joule-opvarmningsteknik til at kontrollere faseudviklingen og dopingen af kulstof. Kr
Blinkede nanodiamanter er kun en fase, forskerholdet finderEt transmissionselektronmikroskopbillede viser et nanodiamantgitter. Rice University kemikere brugte deres flash Joule-opvarmningsteknik til at kontrollere faseudviklingen og dopingen af kulstof. Kr -
 Nyt AI-værktøj kan revolutionere mikroskopiBilledet viser, hvordan et neuralt netværk bruges til at hente interessant information fra et mikroskopbillede. Kredit:Aykut Argun Et AI-værktøj udviklet ved Göteborgs Universitet giver nye muligh
Nyt AI-værktøj kan revolutionere mikroskopiBilledet viser, hvordan et neuralt netværk bruges til at hente interessant information fra et mikroskopbillede. Kredit:Aykut Argun Et AI-værktøj udviklet ved Göteborgs Universitet giver nye muligh
- Hvordan man tester for Hydrogen Sulfide
- Større oversvømmelsesrisici i kystregionen i Kina på grund af langsommere tropiske cyklonbevægel…
- Hvad er forskellen mellem hastighed og acceleration?
- Tak, Gaia:Astronomer spionerer Europa, der blokerer fjern stjerne
- Potentielle assay-artefakter i anti-malaria screening
- Mere reaktive landoverflader kølede Jorden ned


