Dyresimuleringer og smart lægemiddeldesign:Nanomaterialetransport til individuelle celler

In vitro anvendelse af assay ved hjælp af flere celletyper med simulering og hastighedsekstraktion. (A) Fluorescensdata og assay-opsætning, der repræsenterer uvasket QD (QSH) fluorescens for uvaskede brønde, der indeholder nyre (MES13), lever (AML12), endotel (C166), og makrofag (J774a.1) celletyper. AU, vilkårlige enheder. (B) Vasket rå (sort) og kalibreret (rød) fluorescensoptagelseskoncentrationer (cirkler, målt) sammenlignet med simuleringspasninger (linjer) for lever, endotel, makrofager, og nyrecelletyper. (C) Sammenfatning af hastighedskonstanter optimeret af den genetiske algoritme for modeltilpasning til målte datasæt. (D) Tidsafhængige konfokale mikroskopibilleder af QD-optagelse, viser mætning (dobbeltsidede pile) for hver celletype i undersøgelsen (blå og rød repræsenterer cellekernen Hoechst og QSH-fluorescens, henholdsvis). Tegnefilm er en visuel repræsentation af QD-celle interaktionskinetik. Kredit: Videnskabens fremskridt , doi:10.1126/sciadv.aax2642
Bioingeniører kan designe smarte lægemidler til antistof- og nanomateriale-baserede terapier for at optimere lægemiddeleffektiviteten til stadig mere effektiv, tidlige prækliniske forsøg. Det ideelle lægemiddel vil have maksimal effektivitet på målvævssteder til transport fra vævsvaskulaturen til det cellulære miljø. Forskere kan bruge biologiske simuleringer koblet til in vitro-tilgange til at forudsige deres eksponering hurtigt og effektivt til at forudsige lægemiddelbiodistribution inden for enkeltceller af levende dyrevæv uden at stole på dyreforsøg. I en ny undersøgelse, der nu er offentliggjort på Videnskabens fremskridt , Edward Price og Andre J. Gesquiere brugte med succes en in vitro-analyse og computational fluid dynamic (CFD) model til at oversætte in vitro cellekinetik til helkropssimuleringer på tværs af flere arter og nanomaterialetyper. Arbejdet gjorde det muligt for dem at forudsige lægemiddelfordelinger inde i individuelle vævsceller, og holdet forventer, at dette arbejde vil forfine, reducere og erstatte dyreforsøg og samtidig give forskerne et nyt perspektiv på lægemiddeludvikling.
Nanomedicin (NM'er) i form af antistoffer og syntetiske nanomaterialer kan komplementere konventionel småmolekylemedicin gennem aktiv vævsmålretning, variable cirkulationstider og stabilitet, koblet til justerbar biofordeling. Forskerhold er stærkt afhængige af dyremodeller for at kvantificere leverede doser, rejser spørgsmål om etik og stigninger i tid og omkostninger. Fra et videnskabeligt synspunkt, vævsarkitekturdestruktion udført under vævshomogenisering til kvantificering kan eliminere kritisk viden om nanomedicintransport inde i vævsceller og vaskulatur. Et lægemiddel kan nå celler ved at udvise optimal plasmafarmakokinetik for at nå vævsvaskulaturen. Arkitekturen og nanopartikeldiameteren tillader kritisk transport af lægemidlet på tværs af mikrokarvægge ind i et inficeret eller normalt vævscellemiljø.
I nærværende arbejde, Price og Gesquiere koblede en in vitro/in silico-simuleringstilgang til at forudsige NM-biodistribution inden for prækliniske arter (dyre- og cellemodeller) på enkeltcelleniveau. De redegjorde for forskelle i nanopartikelstørrelse, dyrearter og vaskulaturporestørrelsesdiametre ved hjælp af en væskedynamisk model. Holdet kvantificerede cellulært NM-indhold i situationer, hvor resultaterne var svære at oversætte til dyreforsøg på grund af mangel på systematiske perspektiver. De behandlede også eksisterende eksperimentelle problemer, hvor celler inducerede nedbrydning af nanopartikelfluorescens til at producere falske negativer.
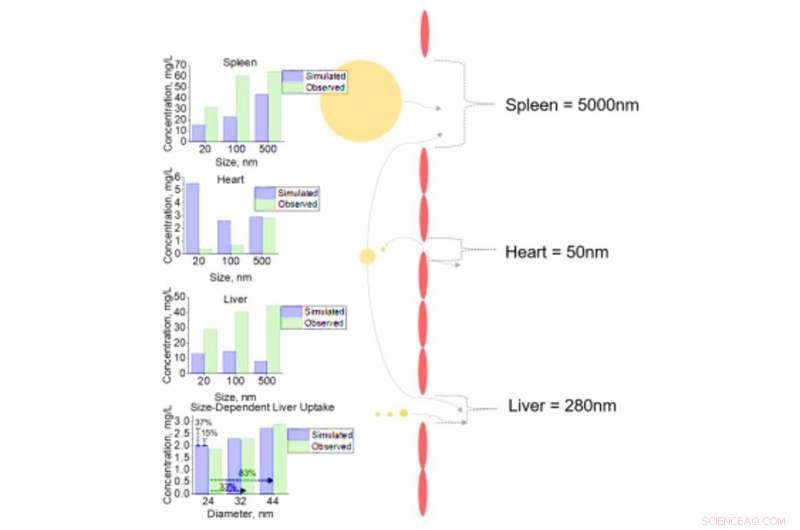
Cellulær analyse af NM-optagelse i varierende væv for NM med forskellige diametre. Cellulær optagelse af NM'er med diametre på 20, 100, og 500nm for milt, hjerte, og lever med fenestrae diametre på 5000, 50, og 280nm henholdsvis. Følsomhedsanalyse af inkrementelle ændringer i NM diameter (24, 32, og 44nm) med efterfølgende levercelleoptagelse blev udført. Alle simulerede (forudsagte) output sammenlignes med observerede data fra litteraturcelledatasæt. Kredit: Videnskabens fremskridt , doi:10.1126/sciadv.aax2642
For at validere deres arbejde in vitro, holdet simulerede lysosomal analyse koblet til atomabsorptionsspektroskopi (AAS), og underbygget in vivo-simuleringer ved at sammenligne resultaterne med den offentliggjorte litteratur af helkropsdyrsdata for rotter, mus og ikke-menneskelige primater. Forskerne brugte kvanteprikker (QD'er) som et modelsystem på grund af deres potentiale i nanopartikeldetektion, mens de også overvejer deres grænser. Price et al. redegjorde for kompleksiteten i en NM-platform for at udvide mulighederne til antistof- og metal/polymer-baserede nanopartikler.
Når en nanopartikel cirkulerer gennem dyrenes blodforsyning for at komme ind i vævsmiljøet, det vil interagere med vævsceller via adsorption, desorption, internalisering eller aktive optagelsesprocesser. Forskerne udsatte nanopartikler for ikke-toksiske QD'er (kvanteprikker) for fluorescerende at detektere deres interaktioner med celler, der almindeligvis stødes på af NM'er, såsom makrofager, endotelceller og epitelceller, efter intravenøs injektion. Forskerholdet kvantificerede koncentrationen af nanopartikler, der interagerer med celler in vitro, og byggede cellekinetik-simuleringer for at vurdere hastighedskinetikken og NM-celle-interaktionerne.
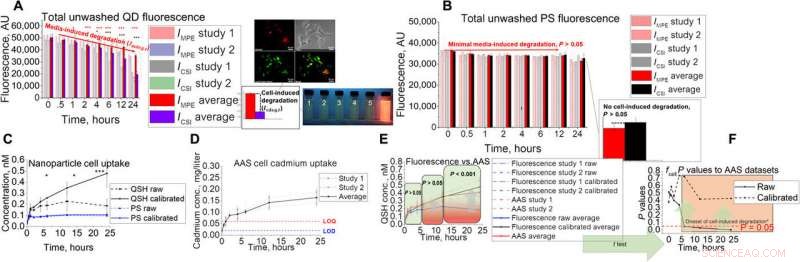
In vitro assay udvikling og validering til AAS. (A og B) In vitro assay-opsætning med dets koblede uvaskede fluorescenssignal for (A) QD og (B) PS. Billeder viser Hepa1-6-kolokalisering af QD i lysosomale rum samt snapshots af fluorescens under ultraviolet belysning under simulerede lysosomale eksponeringsforhold med pH 2,5, 3,0, 3,5, 4,0, 4,5, og 7,4 (1 til 6, henholdsvis). (C til E) QD-optagelsesundersøgelser ved hjælp af in vitro-teknikken med (C) fluorescens, (D) AAS, (E) kombineret, og (F) statistiske resultater ved hjælp af to-halet t-test ved sammenligning af rå og kalibreret fluorescensoptagelse med AAS-data. Stjernerne i figuren repræsenterer signifikans ved * (P <0,05), ** (P <0,01), og *** (P <0,001) niveauer. Kredit: Videnskabens fremskridt , doi:10.1126/sciadv.aax2642
Simuleringen indeholdt et (i) medium, (ii) cellemembran og (iii) cellerumsrum indbyrdes forbundet via grundlæggende masseoverførselsligninger og førsteordens hastighedskonstanter. De optimerede systemet ved hjælp af en genetisk algoritme i MATLAB og bemærkede, at membranadsorptionshastighedskonstanten var højest for makrofager og lavest for endotel- og leverceller. Af celletyper, internaliseringsprocessen var også relativt højest for levervævsceller og lavest for endotelceller. Konfokal billeddannelse understøttede visuelt disse data med hurtig optagelse og mætning af makrofager inden for en time efter eksponering, mens epitel- og endotelvævsceller blev yderligere forsinket.
Holdet demonstrerede tilstedeværelsen af celleredbrydningsfaktorer i in vitro-assays ved hjælp af cellekinetik-simuleringer for at hjælpe effektivt med at oversætte in vitro-dataene til dyreforsøg. Atomadsorptionsspektroskopi (AAS) validerede resultaterne af QD-optagelse via fluorescensassays og fremhævede vigtigheden af at beregne celle- og medium-induceret nedbrydning. Da nanomedicin (NM'er) placeret inde i væv kan ophobes i interstitia, vaskulatur eller inde i en række forskellige celletyper, holdet oversatte in vitro cellulær kinetik til in silico dyresimuleringer for at tage højde for dette. De udførte to pilotundersøgelser og vurderede tendenser i helvævsoptagelse som en funktion af størrelse og kvantificeret NM-optagelse på enkeltcelleniveau. Arkitektonisk, hver simulering af vævsrum indeholdt fire underrum til at repræsentere epitelet, endotel- og makrofagceller.
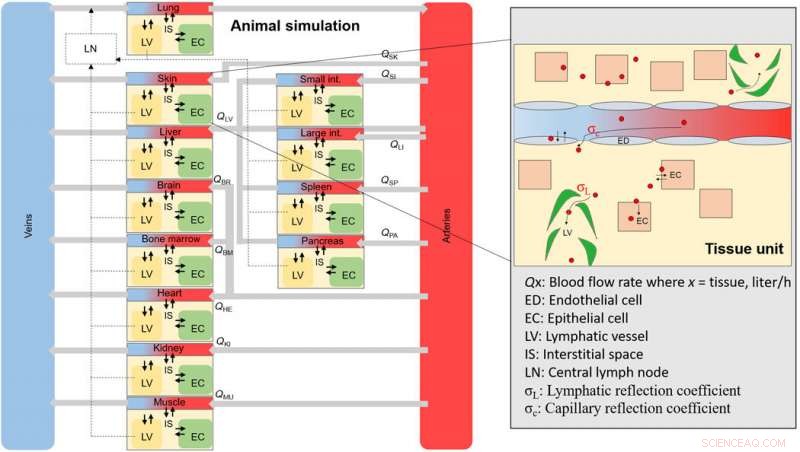
Et overordnet skema af dyre-NM-simuleringen. Skema af det overordnede væv og blodrum, der udgør hele dyret. Hvert vævsrum er forbundet gennem blodgennemstrømningshastigheder og indeholder underrum (indzoomet område), hvor en NM vil fordele sig ved internalisering gennem endothelial fenestrae. Kredit: Videnskabens fremskridt , doi:10.1126/sciadv.aax2642
Da leveren og milten er almindelige mål for NM-akkumulering, de brugte disse væv som casestudier til at forstå og fange, simuleringens følsomhed og nøjagtighed. For eksempel, simuleringen viste, at øgede NM-størrelser oversteg vævsporestørrelserne for de fleste vævstyper for at lede mod væv med større porestørrelser såsom leveren. På dette tidspunkt, leverendotelcellerne interagerede med NM'erne for hurtig membranbinding og mætning inden for 24 timer. Når NM kom ind i interstitia af vævet, interagerede det hurtigt med epitel- (til lever) og makrofag (til milt) vævsceller. Resultaterne opbyggede tillid til simuleringens forudsigelsesevne og dens evne til at forudsige lægemiddelindhold i variabel størrelse på enkeltcelleniveau for dyr for første gang - udelukkende baseret på in vitro-data alene.
Forskerne indikerede derefter simuleringens forudsigelsesevne og translationelle kapacitet ved at sammenligne med målt indhold på vævsniveau for flere NM-typer og arter, inklusive rotter, mus og cellulært indhold (epitel, endotel og makrofag). De testede den prædiktive præstation på tværs af flere variabler baseret på Verdenssundhedsorganisationens retningslinjer og standarder for akademiske og farmaceutiske konsortium for udvikling af lægemidler og sikkerhed. De modelforudsagte gennemsnit og de observerede gennemsnit korrelerede lineært for at indikere rimelige modelforudsigelser på tværs af alle arter og NM-typer.
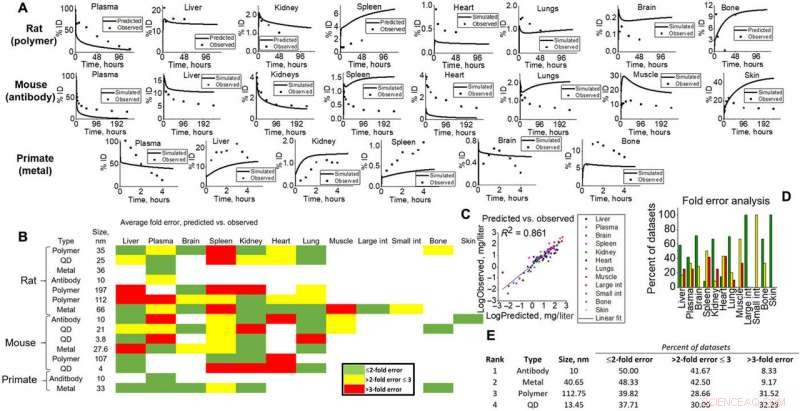
Simuleringsoutput til validering til forskellige dyreforsøg. (A) Vævsniveau forudsagt (linje) versus observerede (point) eksempler for alle artstyper (rotter, mus, og NHP) for visuel dokumentation af modelkapaciteter. (B) Varmekort over foldfejlanalyse beregnet for alt væv, NM, og artstyper i simulering. Grøn, gul, og rød repræsenterer <2 gange, <3 gange, og>3-fold fejl. Foldefejlen blev beregnet i henhold til ligningerne givet i Materialer og Metoder, hvor simulerede datasætgennemsnit blev sammenlignet med observerede. (C) Alle datapunktsgennemsnit, der er specifikke for vævstyper til simuleringer og observeret, blev plottet mod hinanden for at give en lineær tilpasning (R2 =0,861). (D) Vævsspecifikke foldfejl er vist for at visualisere modelnøjagtighed for hvert væv i denne undersøgelse. (E) NM-simulerede output blev rangeret (1 til 4) i henhold til foldfejlanalyse. Kredit: Videnskabens fremskridt , doi:10.1126/sciadv.aax2642
På denne måde Edward Price og Andre J. Gesquiere udviklede en levedygtig platform til at reducere og forfine dyreforsøg under udvikling af nanomedicin (NM). De in vitro-koncentrerede data koblet til cellekinetiksimuleringer leverede celle-NM-interaktioner for at vise fremragende translationspotentiale. Resultaterne krævede ikke tilpasning til dyrebiodistributionsdatasæt, da alle parametre var optimeret til in vitro-data eller beregnet ved hjælp af en væskedynamisk model. Processen fungerede også under forhold med NM-nedbrydning i det biologiske miljø. De kombinerede in vitro- og in silico-teknikker vil hjælpe fremtidens smarte lægemiddeldesign for at hjælpe videnskabsmænd med at danne bedre og informerede diskussioner og samtidig reducere forsøg med levende dyr. Price og Gesquiere forventer, at dette arbejde vil tjene en ny tilgang til prædiktive simuleringer af nanomedicintransport.
© 2020 Science X Network
 Varme artikler
Varme artikler
-
 Ny uikidama nanopartikelstruktur afsløretJapansk glasfiskerflyder—ukidama. Kredit:OIST Nogle gange er det de små ting i verden, der kan gøre en utrolig forskel. En af disse ting er nanopartiklerne. Nanopartikler kan være små, men de har
Ny uikidama nanopartikelstruktur afsløretJapansk glasfiskerflyder—ukidama. Kredit:OIST Nogle gange er det de små ting i verden, der kan gøre en utrolig forskel. En af disse ting er nanopartiklerne. Nanopartikler kan være små, men de har -
 Forbedring af de elektriske og mekaniske egenskaber af kulstof-nanorør-baserede fibrePostdoc-forsker Gang Wang indlæser en prøve i systemet, der bruges til at udføre nanorør-tværbindingsoperationen, mens Joseph Lyding ser på. Kredit:Doris Dahl, Beckman Instituttet, University of Illin
Forbedring af de elektriske og mekaniske egenskaber af kulstof-nanorør-baserede fibrePostdoc-forsker Gang Wang indlæser en prøve i systemet, der bruges til at udføre nanorør-tværbindingsoperationen, mens Joseph Lyding ser på. Kredit:Doris Dahl, Beckman Instituttet, University of Illin -
 Fysikere fandt den temperatur, ved hvilken kulstofnanorør blev superledereDen geometriske struktur en kulkæde i et rør før og efter optimering. Kredit:Chi Ho Wong Forskere fra Ural Federal University (UrFU) sammen med deres kolleger fra Lomonosov Moscow State University
Fysikere fandt den temperatur, ved hvilken kulstofnanorør blev superledereDen geometriske struktur en kulkæde i et rør før og efter optimering. Kredit:Chi Ho Wong Forskere fra Ural Federal University (UrFU) sammen med deres kolleger fra Lomonosov Moscow State University -
 Ny metode forbedrer stabiliteten af perovskit -kvantepunkterElektronmikroskopibilleder af perovskit -kvantepunkter indlejret i den beskyttende aluminiumoxidmatrix, og et fotografi af den samme filmstald i vand. Kredit:R. Buonsanti/EPFL EPFL -forskere har b
Ny metode forbedrer stabiliteten af perovskit -kvantepunkterElektronmikroskopibilleder af perovskit -kvantepunkter indlejret i den beskyttende aluminiumoxidmatrix, og et fotografi af den samme filmstald i vand. Kredit:R. Buonsanti/EPFL EPFL -forskere har b
- Eclypsium sikkerhedsrapport viser usigneret firmware som vedvarende hovedpine
- Sætte gas under tryk
- 3 måder at hjælpe seksualforbrydere med at genintegrere sikkert tilbage i samfundet
- Ressourceudtømning er et alvorligt problem, men fodaftryksvurderinger fortæller os ikke meget om d…
- Nye silkematerialer kan rynkes til detaljerede mønstre, derefter rynke for at blive genoptrykt
- Historiske film forfalder muligvis meget hurtigere, end vi troede, takket være eddikesyndrom


