Guld nanopartikler afslører amyloid fibriller
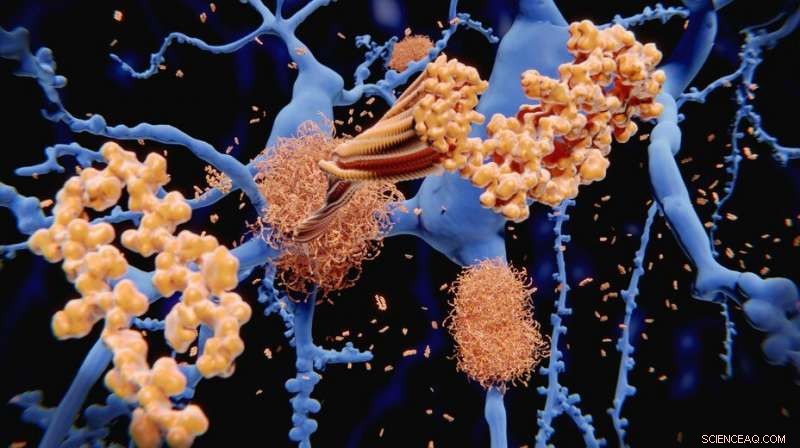
Amyloid-beta-peptidet akkumuleres til amyloidfibriller, der opbygger tætte amyloide plaques. Kredit:selvanegra. Kredit:iStock fotos
EPFL-forskere har udviklet kraftfulde værktøjer til at afsløre mangfoldigheden af amyloidfibriller, som er forbundet med Alzheimers sygdom og andre neurodegenerative lidelser. Forskerne fik gennembruddet ved at udvikle guld nanopartikler, der kombineres med kryogen transmissionselektronmikroskopi, at give hurtige og hidtil usete billeder af fibriller.
Et af kendetegnene ved Alzheimers sygdom er tilstedeværelsen af knudelignende strukturer mellem hjerneceller. Disse kaldes "amyloid fibriller" og er dannet af det berygtede amyloid beta peptid og Tau protein, som er to af de mest eftertragtede mål for udvikling af terapier til behandling af Alzheimers og lignende sygdomme.
Både amyloid beta og Tau produceres normalt i hjernen. Imidlertid, disse proteiner kan begynde at blive viklet ind i hinanden for at danne voluminøse fibrilstrukturer. Når dette sker, de giver anledning til lidelser som Alzheimers sygdom og andre neurodegenerative sygdomme.
Fibrilstrukturerne spredes i hele hjernen ved at flytte fra en celle til en anden. Dette menes at føre til degeneration af neuroner, forårsager hjerneskade og kognitive svækkelser som hukommelsestab, og forskningsindsatsen har generelt fokuseret på at blokere disse processer for at bremse udviklingen af sygdommen.
Vi ved nu, at disse amyloidfibriller kan eksistere i flere former og strukturer, der udviser forskellige særskilte egenskaber, hvilket kan forklare, hvorfor Alzheimers og Parkinsons sygdomspatienter viser forskellige kliniske symptomer. Derfor, at fange denne mangfoldighed og korrelere med sygdomssymptomer hos mennesker eller den biologiske aktivitet af disse arter i sygdomsmodeller har vigtige implikationer for forståelsen af sygdomsmekanismer og udvikling af nye terapier og diagnostik.
I betragtning af vigtigheden af amyloidfibriller, der har været mange bestræbelser på at visualisere dem så detaljeret som muligt for at få indsigt i deres struktur. Optrævling af deres strukturelle detaljer kan muligvis føre til påvisning af svage punkter, der kan målrettes til behandling og bane vejen for udvikling af mere pålidelige diagnostiske værktøjer. Trods meget arbejde, imidlertid, billeddannelse og indfangning af mangfoldigheden af fibriller i biologiske prøver har vist sig at være meget vanskelig på grund af deres komplekse natur og heterogenitet.
Vejen til guld (nanopartikler)
Nu, forskere fra grupperne Francesco Stellacci og Hilal Lashuel ved EPFL har fundet en løsning. I et banebrydende papir udgivet i PNAS , forskerne viser, at guld amfifile anioniske nanopartikler med en diameter omkring 3 nm, har en unik evne til effektivt at mærke kanten af amyloidfibriller i en hydreret tilstand. Dette gør visualiseringen af de forskellige amyloidfibriller lettere.
Forskningsprojektet blev ledet af ph.d. studerende Urszula Cendrowska og Dr. Paulo J. Silva.
Dette var muligt ved at afbilde de nanopartikler-dekorerede fibriller ved hjælp af en specialiseret form for TEM kaldet "kryogen transmissionselektronmikroskopi" (cryo-EM). Den største forskel her er, at i cryo-EM fryses prøven - her fibrillerne - først hurtigt til en meget lav temperatur og kan visualiseres i sin "naturlige" tilstand uden at skulle fikseres eller farves på forhånd.
Mellem den højeffektive binding af guldnanopartikler og mulighederne i cryo-EM, forskerne var i stand til at få billeder af fibriller og afsløre deres mangfoldighed med hidtil uset klarhed. Dette omfattede fibriller dyrket i laboratoriet såvel som fra faktiske postmortem-væv fra patienter.
"Vores resultater afslører en slående morfologisk forskel mellem fibrillerne produceret i cellefri systemer og dem, der er isoleret fra patienter, " siger Stellacci. "Dette understøtter den nuværende opfattelse af, at det fysiologiske miljø spiller en stor rolle i bestemmelsen af forskellige typer af amyloidfibriller."
"Disse fremskridt baner vejen for at belyse det strukturelle grundlag for amyloidstammer og toksicitet, " siger Lashuel. "Nanopartiklerne er kraftfulde og desperat nødvendige værktøjer til hurtig billeddannelse og profilering af amyloid morfologisk polymorfi i forskellige typer prøver under kryo-betingelser, især komplekse prøver isoleret fra human-afledte patologiske aggregater."
Sidste artikelNanopartikelbaseret termisk behandling helbreder tarmkræft hos mus
Næste artikelNy universel bæreblæk til 3D-print
 Varme artikler
Varme artikler
-
 Team udvikler ny måde at studere nanopartikler påEn enkelt guld plasmonisk nanoantenne sonderer brintabsorptionen i en tilstødende palladium nanokube. Kredit:Ella Marushchenko og Alex Tokarev Forskere ved Chalmers Teknologiske Universitet har ud
Team udvikler ny måde at studere nanopartikler påEn enkelt guld plasmonisk nanoantenne sonderer brintabsorptionen i en tilstødende palladium nanokube. Kredit:Ella Marushchenko og Alex Tokarev Forskere ved Chalmers Teknologiske Universitet har ud -
 Biosensor-chip muliggør højfølsom proteinanalyse til sygdomsdiagnoseMuliggør synlighed af DNA -bevægelse I kampen mod kræft og andre sygdomme, præcis analyse af specifikke proteiner kan pege vejen mod målrettede behandlinger. Forskere ved Technische Universitaet M
Biosensor-chip muliggør højfølsom proteinanalyse til sygdomsdiagnoseMuliggør synlighed af DNA -bevægelse I kampen mod kræft og andre sygdomme, præcis analyse af specifikke proteiner kan pege vejen mod målrettede behandlinger. Forskere ved Technische Universitaet M -
 Nanoenheder til hjernen kunne forhindre dannelsen af Alzheimers plaquesTransmission Electron Microscopy (TEM) billeder af Aβ-peptidprøver i nærværelse af Aβ-nanoenheder (skalalinje:200 nm). Manglen på korn på billedet indikerer effektiviteten af nanoenheden til at fang
Nanoenheder til hjernen kunne forhindre dannelsen af Alzheimers plaquesTransmission Electron Microscopy (TEM) billeder af Aβ-peptidprøver i nærværelse af Aβ-nanoenheder (skalalinje:200 nm). Manglen på korn på billedet indikerer effektiviteten af nanoenheden til at fang -
 Plastiske nanopartikler gør larve -zebrafisk hyperaktivNanoplast påvirker adfærden hos larvezebrafisk, siger ny forskning fra Institute of Biology Leiden (IBL) og Institute of Environmental Sciences (CML). Forskerne observerede, at en bestemt type nanopar
Plastiske nanopartikler gør larve -zebrafisk hyperaktivNanoplast påvirker adfærden hos larvezebrafisk, siger ny forskning fra Institute of Biology Leiden (IBL) og Institute of Environmental Sciences (CML). Forskerne observerede, at en bestemt type nanopar
- GN Hearing håber at forbinde Android -telefoner og høreapparater
- Forskere syntetiserer grafenlignende materiale:Polymer med bikagestruktur
- Sætter et nyt spin på Majorana fermioner
- Sådan beregnes Hvilken grad jeg har brug for på final
- Eksperimentel fingeraftrykstest kan skelne mellem dem, der har taget eller håndteret kokain
- I varmere klimaer, Grønlandske deltaer er vokset, ny analyse af 75 år gamle luftfotos bekræfter


