Eksperimenter med mus og menneskeceller kaster lys over den bedste måde at levere nanopartikelterapi mod kræft
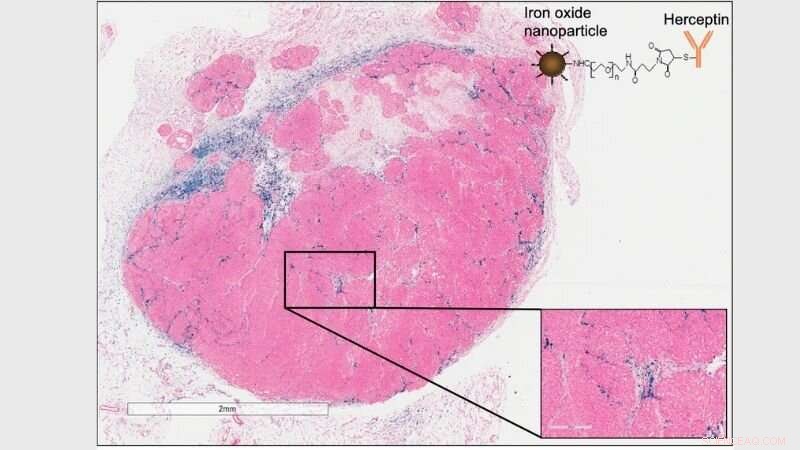
Histologisk billede af HER2+ tumor, der viser akkumulering af Herceptin-mærket nanopartikel (øverst til højre, og blå i histologi) akkumulering i tumormikromiljø (immun) og ikke på HER2+ cancerceller. Kredit:Robert Ivkov, Ph.D.
Forskere i det cancer nanomedicinske samfund diskuterer, om brugen af små strukturer, kaldet nanopartikler, bedst kan levere lægemiddelbehandling til tumorer passivt - hvilket tillader nanopartiklerne at diffundere ind i tumorer og blive holdt på plads, eller aktivt – tilføjelse af et målrettet anti-cancer-molekyle for at binde sig til specifikke cancercelle-receptorer og, i teorien, holde nanopartiklerne i tumoren længere. Nu, ny forskning på menneske- og musetumorer i mus af efterforskere ved Johns Hopkins Kimmel Cancer Center antyder, at spørgsmålet er endnu mere kompliceret.
Laboratorieundersøgelser, der tester begge metoder i seks modeller af brystkræft; fem humane kræftcellelinjer og en musekræft hos mus med tre varianter af immunsystemet fandt, at nanopartikler belagt med trastuzumab, et lægemiddel, der er rettet mod human epidermal vækstfaktor receptor 2 (HER2)-positive brystkræftceller, blev bedre tilbageholdt i tumorerne end almindelige nanopartikler, selv i tumorer, der ikke udtrykte pro-vækst HER2-proteinet. Imidlertid, immunceller fra værten udsat for nanopartikler inducerede en anti-cancer immunrespons ved at aktivere T-celler, der invaderede og bremsede tumorvækst.
En beskrivelse af arbejdet vil blive offentliggjort den 25. marts i Videnskabens fremskridt .
"Det har været kendt i lang tid, at nanopartikler, når det injiceres i blodbanen, opfanges af skurvognslignende makrofager og andre immunsystemceller, " forklarer senior studieforfatter Robert Ivkov, Ph.D., M.Sc., lektor i strålingsonkologi og molekylær strålingsvidenskab ved Sidney Kimmel Comprehensive Cancer Center ved Johns Hopkins. "Mange forskere på området har været fokuseret på at forsøge at reducere interaktioner med immunceller, fordi de har forsøgt at øge cirkulationstiden for nanopartiklerne og deres tilbageholdelse i tumorceller. Men vores undersøgelse viser, at immuncellerne i tumoren samler sig og reagerer på partiklerne på en sådan måde, at de stimulerer et anti-cancerrespons. Dette kan rumme potentiale for at gå videre end lægemiddellevering mod udvikling af cancerimmunterapier."
Forskerne udførte et par in vitro-eksperimenter i deres undersøgelse. Først, de påførte nogle almindelige stivelsesbelagte jernoxidnanopartikler og andre belagt med trastuzumab på fem humane brystkræftcellelinjer, fandt ud af, at mængden af binding mellem de trastuzumab-coatede nanopartikler og celler afhang af, hvor meget kræftcellerne udtrykte onkogenet HER2. Hos mennesker, HER2-positive brystkræftformer er blandt de mest resistente over for standard kemoterapi. Trastuzumab, sælges under navnet Herceptin, retter sig mod de HER2-positive tumorceller og udløser også immunsystemet.
Svarene var overraskende forskellige i dyremodeller, rapporterer forskerne. I separate forsøg, holdet brugte nanopartiklerne i to immundefekte musestammer podet med celler fra fem humane brystkræftcellelinjer - to, der var HER2-negative og tre, der var HER2-positive. Da de studerede dyrenes tumorer 24 timer senere, de bemærkede, at nanopartikler belagt med trastuzumab blev fundet i en koncentration to til fem gange større end de almindelige nanopartikler i alle typer af tumorer, uanset om de udtrykte HER2-proteinet. De fandt også, at mængden af trastuzumab-coatede nanopartikler var endnu større (tifold) hos mus, der havde et fuldt funktionelt immunsystem og bar muse-afledte tumorer.
Dette fik forskerne til at mistænke, at værtsdyrenes immunsystem interagerede stærkt med nanopartiklerne og spillede en rolle i at bestemme tilbageholdelse af partiklerne i tumoren, om der er tilsat et lægemiddel eller ej.
Flere eksperimenter, holdet rapporterer, afslørede, at tumor-associerede immunceller var ansvarlige for at indsamle nanopartiklerne, og at mus opdrættet med et intakt immunsystem beholdt flere af de trastuzumab-coatede nanopartikler end mus opdrættet uden et fuldt fungerende immunsystem.
Ud over, inflammatoriske immunceller i tumorernes umiddelbare omgivelser, eller mikromiljø, beslaglagt flere af de coatede nanopartikler end de almindelige. Endelig, i en række 30-dages eksperimenter, forskerne fandt ud af, at eksponering for nanopartikler hæmmede tumorvækst tre til fem gange mere end kontroller, og øget CD8-positive cancer-dræbende T-celler i tumorerne. Overraskende nok, Ivkov bemærker, den anti-cancer immunaktiverende respons var lige effektiv med eksponering for enten almindelige eller trastuzumab-coatede nanopartikler. Mus med defekte T-celler viste ikke tumorvækstinhibering. Efterforskerne siger, at dette viste, at systemisk eksponering for nanopartikler kan forårsage en systemisk værtsimmunrespons, der fører til anti-cancer immunstimulering, og kræver ikke, at nanopartikler er inde i tumorerne.
"Samlet set, vores arbejde tyder på, at der eksisterer komplekse indbyrdes afhængigheder mellem værtens og tumorens immunrespons på nanopartikeleksponering, " Ivkov siger. "Disse resultater tilbyder spændende muligheder for at udforske nanopartikel 'målretning' af tumorens immunmikromiljø. De demonstrerer også spændende nyt potentiale til at udvikle nanopartikler som platforme for kræftimmunterapier."
Efterforskerne siger, at de også planlægger at undersøge, om de samme typer immunresponser kan genereres for ikke-kræfttilstande, såsom infektionssygdomme.
 Varme artikler
Varme artikler
-
 Energiproduktionsteknologi baseret på piezoelektriske nanokompositmaterialerNanokompositgenerator producerer elektricitet. Kredit:KAIST Professor Keon-Jae Lees forskerhold, KAIST (Korea), har udviklet en nanokomposit-baseret nanogenerator, der med succes overvinder de kri
Energiproduktionsteknologi baseret på piezoelektriske nanokompositmaterialerNanokompositgenerator producerer elektricitet. Kredit:KAIST Professor Keon-Jae Lees forskerhold, KAIST (Korea), har udviklet en nanokomposit-baseret nanogenerator, der med succes overvinder de kri -
 Forskere finder en ny måde at efterligne farven og teksturen af sommerfuglevingerYangs gruppe har en ny måde at kombinere den strukturelle farve og superhydrofobicitet, der findes i sommerfuglevinger. Denne dråbe vand sidder på en wafer lavet med deres proces. Kredit: Avancerede f
Forskere finder en ny måde at efterligne farven og teksturen af sommerfuglevingerYangs gruppe har en ny måde at kombinere den strukturelle farve og superhydrofobicitet, der findes i sommerfuglevinger. Denne dråbe vand sidder på en wafer lavet med deres proces. Kredit: Avancerede f -
 Fremstilling af bittesmå antenner til bærbar elektronikKredit:American Chemical Society Når det kommer til elektronik, større er normalt ikke bedre. Dette gælder især for en ny generation af bærbare kommunikationssystemer, der lover at forbinde mennes
Fremstilling af bittesmå antenner til bærbar elektronikKredit:American Chemical Society Når det kommer til elektronik, større er normalt ikke bedre. Dette gælder især for en ny generation af bærbare kommunikationssystemer, der lover at forbinde mennes -
 Undersøgelse af nye måder at styre termisk stråling påKredit:Lawrence Berkeley National Laboratory Når forskere forsøger at gøre tingene bedre, de vil ofte vende sig til en standardregel og forsøge at modbevise eller forstyrre den. Et konsortium af
Undersøgelse af nye måder at styre termisk stråling påKredit:Lawrence Berkeley National Laboratory Når forskere forsøger at gøre tingene bedre, de vil ofte vende sig til en standardregel og forsøge at modbevise eller forstyrre den. Et konsortium af
- Zombie replika celler kan udkonkurrere levende celler som katalysatorer og ledere
- Samarbejde i deres forsyningskæder kan hjælpe virksomheder med at komme sig hurtigere, siger ekspe…
- Efter spild af Deepwater Horizon, østersstørrelse ændrede sig ikke
- Idéer til eksperiment på gymnasiologi
- Ny sensor til forbedring af intensiv overvågning af vejrtrækning
- Indeks afslører problemer med integritet for mange af verdens skove


