Sølv nanokuber gør diagnostik på stedet nemmere at læse
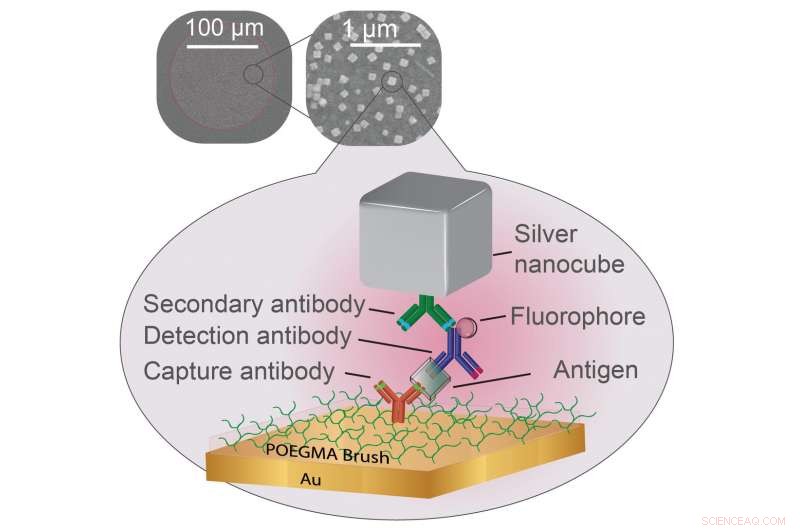
Forskere har vist, at plasmonics kan forbedre de fluorescerende markører, der bruges til at signalere positive prøver i visse typer test for sygdomme. En polymer børstebelægning holder uønskede biomolekyler væk, mens et indfangningsantistof (rødt) fanger biomarkører for sygdom (klar). Et detektionsantistof (blåt) låses derefter på biomarkøren og udsender lys fra en vedhæftet fluorofor (sfære). Alt dette er klemt ind af et tyndt lag guld og en sølv nanokube, der er fastgjort af et tredje antistof (grønt), skabe betingelser for, at fluoroforen udsender stærkere lys. Kredit:Daniela Cruz, Duke University
Ingeniører ved Duke University har vist, at sølvterninger i nanostørrelse kan gøre diagnostiske test, der er afhængige af fluorescens, nemmere at læse ved at gøre dem mere end 150 gange lysere. Kombineret med en ny point-of-care diagnostisk platform, der allerede er vist i stand til at detektere små spor af vira og andre biomarkører, tilgangen kunne gøre det muligt for sådanne test at blive meget billigere og mere udbredt.
Resultaterne blev vist online den 6. maj i tidsskriftet Nano bogstaver .
Plasmonik er et videnskabeligt felt, der fanger energi i en feedback-loop kaldet en plasmon på overfladen af sølv nanokuber. Når fluorescerende molekyler er klemt mellem en af disse nanokuber og en metaloverflade, samspillet mellem deres elektromagnetiske felter får molekylerne til at udsende lys meget kraftigere. Maiken Mikkelsen, James N. og Elizabeth H. Barton Associate Professor of Electrical and Computer Engineering ved Duke, har arbejdet med sit laboratorium på Duke for at skabe nye typer hyperspektrale kameraer og superhurtige optiske signaler ved hjælp af plasmonics i næsten et årti.
På samme tid, forskere i laboratoriet i Ashutosh Chilkoti, Alan L. Kaganov Distinguished Professor of Biomedical Engineering, har arbejdet på en selvstændig, point-of-care diagnostisk test, der kan udvælge spormængder af specifikke biomarkører fra biomedicinske væsker såsom blod. Men fordi testene er afhængige af fluorescerende markører for at indikere tilstedeværelsen af biomarkørerne, at se det svage lys af en knap positiv test kræver dyrt og omfangsrigt udstyr.
"Vores forskning har allerede vist, at plasmonik kan forbedre lysstyrken af fluorescerende molekyler titusindvis af gange, " sagde Mikkelsen. "At bruge det til at forbedre diagnostiske assays, der er begrænset af deres fluorescens, var helt klart en meget spændende idé."
"Der er ikke mange eksempler på mennesker, der bruger plasmonforstærket fluorescens til point-of-care diagnostik, og de få, der eksisterer, er endnu ikke blevet implementeret i klinisk praksis, " tilføjede Daria Semeniak, en kandidatstuderende i Chilkotis laboratorium. "Det har taget os et par år, men vi tror, vi har udviklet et system, der kan fungere."
I det nye blad, forskere fra Chilkoti laboratoriet bygger deres superfølsomme diagnostiske platform kaldet D4 Assay på en tynd film af guld, den foretrukne yin til den plasmoniske sølv nanocubes yang. Platformen starter med et tyndt lag polymerbørstebelægning, hvilket forhindrer alt i at klæbe til guldoverfladen, som forskerne ikke ønsker at klæbe der. Forskerne bruger derefter en inkjet-printer til at fastgøre to grupper af molekyler, der er skræddersyet til at låse fast på den biomarkør, som testen forsøger at opdage. Et sæt er fastgjort permanent til guldoverfladen og fanger den ene del af biomarkøren. Den anden vaskes af overfladen, når testen begynder, binder sig til en anden del af biomarkøren, og blinker for at indikere, at den har fundet sit mål.
Efter flere minutter er gået for at tillade reaktionerne at opstå, resten af prøven vaskes væk, efterlader kun de molekyler, der har formået at finde deres biomarkør-matches, svævende som fluorescerende beacons bundet til et gyldent gulv.

En forsker har en testversion af D4-analysen, som har vist sig at kunne påvise spormængder af sygdomsbiomarkører. Kredit:Michaela Kane, Duke University
"Den virkelige betydning af analysen er polymerbørstebelægningen, " sagde Chilkoti. "Polymerbørsten giver os mulighed for at opbevare alle de værktøjer, vi har brug for på chippen, samtidig med at vi bevarer et enkelt design."
Mens D4-analysen er meget god til at fange små spor af specifikke biomarkører, hvis der kun er spormængder, de fluorescerende beacons kan være svære at se. Udfordringen for Mikkelsen og hendes kolleger var at placere deres plasmoniske sølv nanokuber over beacons på en sådan måde, at de overladede beacons' fluorescens.
Men som det plejer, det var lettere sagt end gjort.
"Afstanden mellem sølvnanokuberne og guldfilmen dikterer, hvor meget lysere det fluorescerende molekyle bliver, " sagde Daniela Cruz, en kandidatstuderende, der arbejder i Mikkelsens laboratorium. "Vores udfordring var at gøre polymerbørstebelægningen tyk nok til at fange biomarkørerne - og kun biomarkørerne af interesse - men tynd nok til stadig at forbedre de diagnostiske lys."
Forskerne forsøgte to tilgange til at løse denne Guldlok-gåde. De tilføjede først et elektrostatisk lag, der binder til detektormolekylerne, der bærer de fluorescerende proteiner, skabe en slags "anden etage", som sølvnanokuberne kunne sidde ovenpå. De forsøgte også at funktionalisere sølvnanokuberne, så de ville holde sig direkte til individuelle detektormolekyler på en-til-en-basis.
Mens begge tilgange lykkedes med at øge mængden af lys, der kom fra beacons, førstnævnte viste den bedste forbedring, øger dens fluorescens med mere end 150 gange. Imidlertid, denne metode kræver også et ekstra trin med at skabe en "anden sal, "hvilket tilføjer endnu en hindring for at udvikle en måde at få dette til at fungere på en kommerciel point-of-care diagnostik snarere end kun i et laboratorium. Og selvom fluorescensen ikke forbedredes så meget i den anden tilgang, testens nøjagtighed gjorde.
"At bygge mikrofluidiske laboratorie-på-en-chip-enheder gennem begge metoder ville tage tid og ressourcer, men de er begge gennemførlige i teorien, sagde Cassio Fontes, en kandidatstuderende i Chilkoti-laboratoriet. "Det er, hvad D4-analysen bevæger sig hen imod."
Og projektet går fremad. Tidligere på året, forskerne brugte foreløbige resultater fra denne forskning til at sikre en femårig, $3,4 millioner R01 forskningspris fra National Heart, Lunge, og Blodinstituttet. Samarbejdspartnerne vil arbejde på at optimere disse fluorescensforbedringer, mens de integrerer brønde, mikrofluidkanaler og andre billige løsninger til en enkelt-trins diagnostisk enhed, der kan køre gennem alle disse trin automatisk og læses af et almindeligt smartphone-kamera i en billig enhed.
"En af de store udfordringer i point-of-care tests er evnen til at udlæse resultater, som normalt kræver meget dyre detektorer, " sagde Mikkelsen. "Det er en stor blokering for at have engangstests, der giver patienterne mulighed for at overvåge kroniske sygdomme i hjemmet eller til brug i miljøer med lav ressource. Vi ser denne teknologi ikke kun som en måde at komme uden om den flaskehals, men også som en måde at forbedre nøjagtigheden og tærsklen for disse diagnostiske enheder."
Sidste artikelNanofibermembraner omdannet til 3-D stilladser
Næste artikelTransistor sætter en ny standard for energieffektivitet
 Varme artikler
Varme artikler
-
 Ny fleksibel, gennemsigtig, bærbar biopatch, forbedrer cellulær observation, medicinafgivelseForskere fra Purdue University har skabt en metode til levering af lægemidler ved hjælp af siliciumnano-nåle med diametre, der er 100 gange mindre end en mygsnål. Disse nanonåle er indlejret i et stræ
Ny fleksibel, gennemsigtig, bærbar biopatch, forbedrer cellulær observation, medicinafgivelseForskere fra Purdue University har skabt en metode til levering af lægemidler ved hjælp af siliciumnano-nåle med diametre, der er 100 gange mindre end en mygsnål. Disse nanonåle er indlejret i et stræ -
 Sommerfuglvinger + carbon nanorør =nyt nanobiokompositmaterialeUdnytter de fantastiske naturlige egenskaber ved Morpho sommerfuglens vinger, forskere har udviklet et nanobiokompositmateriale, der viser løfte om bærbare elektroniske enheder, yderst følsomme lyss
Sommerfuglvinger + carbon nanorør =nyt nanobiokompositmaterialeUdnytter de fantastiske naturlige egenskaber ved Morpho sommerfuglens vinger, forskere har udviklet et nanobiokompositmateriale, der viser løfte om bærbare elektroniske enheder, yderst følsomme lyss -
 Forskere udvikler ny teknik til polering af overflader på nanoskalaAFM af overfladen af 6H-SiC. Til venstre:overflade før planarisering; til højre:efter 15 minutters stråling med ion-klyngestråle. Kredit:National Research Nuclear University I øjeblikket, den vi
Forskere udvikler ny teknik til polering af overflader på nanoskalaAFM af overfladen af 6H-SiC. Til venstre:overflade før planarisering; til højre:efter 15 minutters stråling med ion-klyngestråle. Kredit:National Research Nuclear University I øjeblikket, den vi -
 Grafan giver nyt potentiale:Fysikere graver teoretiske brønde for at mine kvanteprikkerRisforskere skabte disse fantasifulde billeder af elektrontætheder ud fra deres grafanindlejrede kvanteprikberegninger. Isooverfladerne afbilder elektroner i valancebåndet, der, i virkeligheden, ville
Grafan giver nyt potentiale:Fysikere graver teoretiske brønde for at mine kvanteprikkerRisforskere skabte disse fantasifulde billeder af elektrontætheder ud fra deres grafanindlejrede kvanteprikberegninger. Isooverfladerne afbilder elektroner i valancebåndet, der, i virkeligheden, ville
- Kvantfysik:Ménage à trois foton-stil
- Myanmar jordskred dræber 34, mange flere frygtede savnet
- Boeing afslutter softwareopdatering til et fly med jordforbindelse
- Simulering af det usynlige
- Hvilke tre betingelser er ideelle for bakterier at vokse?
- Hvordan man forklarer faser af månen og tidene til børn


