Hvor smart, ultratynde nanoplader går på fiskeri efter proteiner
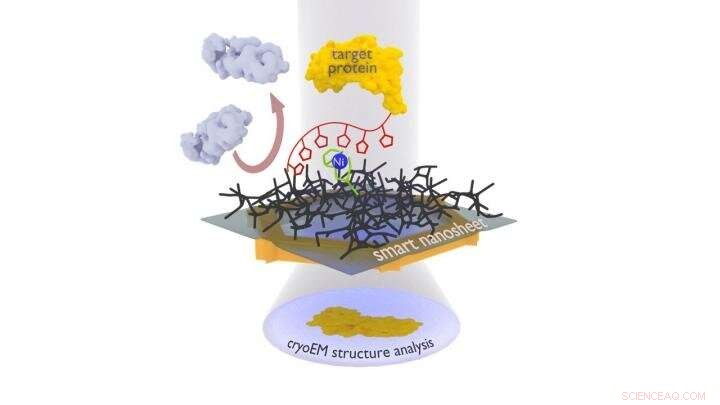
Proteinkomplekset, der skal undersøges (gult), fastgøres til det smarte nanoark via et nikkelkompleks ved hjælp af en markør (rød kæde med femkanter). Uønskede proteiner (grå) frastødes af hydrogelen (sort gitter). Efter frysning af hele strukturen, inklusive en tynd hinde vand, dette kan bestråles med elektroner for at få billeder af de bundne proteiner, hvorfra en computer så kan beregne 3D-strukturen af proteinet. Kredit:Andrey Turchanin/Zian Tang
Et tværfagligt team fra Frankfurt og Jena har udviklet en slags madding, som man kan fiske proteinkomplekser med ud af blandinger. Takket være denne lokkemad, ' det ønskede protein er meget hurtigere tilgængeligt til yderligere undersøgelse i elektronmikroskopet. Forskerholdet har døbt dette innovative lag af ultratyndt molekylært kulstof til det 'smarte nanoark'. Ved hjælp af denne nye udvikling, sygdomme og deres behandling med lægemidler kan forstås bedre, for eksempel.
"Med vores proces, nye typer proteiner kan isoleres fra blandinger og karakteriseres inden for en uge, " forklarer Daniel Rhinow fra Max Planck Institute of Biophysics i Frankfurt. "Hidtil har bare isoleringen af proteinerne var ofte en del af en doktorgrad, der varede flere år." Sammen med Andreas Terfort (Goethe University) og Andrey Turchanin (Friedrich Schiller University Jena), ideen udviklede sig for et par år siden om at fiske de ønskede proteiner direkte ud af blandinger ved at udstyre et nanoark med genkendelsessteder, som målproteinet binder sig til. Det er nu lykkedes forskerne at gøre proteiner direkte tilgængelige til undersøgelse ved hjælp af elektronkryo-mikroskopi gennem et "smart nanoark".
Elektron kryo-mikroskopi er baseret på stødfrysning af en prøve ved temperaturer under -150 °C. I denne proces, proteinet bevarer sin struktur, ingen forstyrrende fikserings- og farvestoffer er nødvendige, og elektronerne kan nemt bestråle den frosne genstand. Resultatet er høj opløsning, tredimensionelle billeder af de mindste strukturer - for eksempel af vira og DNA, næsten ned til et brintatoms skala.
Under forberedelse, proteinerne er stødfrosset i et ekstremt tyndt lag vand på et minutiøst metalgitter. Tidligere, prøver skulle renses i en kompleks procedure - ofte involveret et omfattende tab af materiale - før deres undersøgelse i et elektronmikroskop. Elektronmikroskopi-proceduren er kun vellykket, hvis kun én type protein er bundet i vandlaget.
Forskergruppen ledet af Turchanin bruger nu nanoark, der kun er en nanometer tykke og består af et tværbundet molekylært selvsamlet monolag. Terforts gruppe overtrækker dette nanoark med et geleringsmiddel som grundlag for den tynde vandfilm, der er nødvendig til frysning. Forskerne knytter derefter genkendelsessteder (en speciel nitrilotrieddikesyregruppe med nikkelioner) til den. Holdet ledet af Rhinow bruger de smarte nanoark behandlet på denne måde til at fiske proteiner ud af en blanding. Disse var på forhånd markeret med en histidinkæde, med hvilken de binder til genkendelsesstederne; alle andre forstyrrende partikler kan skylles af. Nanoarket med det bundne protein kan derefter undersøges direkte med elektronmikroskopet.
"Vores smarte nanoark er særligt effektive, fordi hydrogellaget stabiliserer den nødvendige tynde vandfilm og samtidig undertrykker den ikke-specifikke binding af forstyrrende partikler, " forklarer Julian Scherr fra Goethe Universitet. "På denne måde, molekylær strukturbiologi kan nu undersøge proteinstrukturer og -funktioner meget hurtigere." Den viden, der opnås herfra, kan bruges, for eksempel, for bedre at forstå sygdomme og deres behandling med lægemidler.
Holdet har patenteret de nye nanoark og desuden allerede fundet en producent, der vil bringe dette nyttige værktøj på markedet.
 Varme artikler
Varme artikler
-
 Se først på, hvordan individuelle Staphylococcus-celler klæber til nanostrukturer, kan føre til …Dette scanningselektronmikroskopibillede afslører, hvordan Staphylococcus Aureus-celler fysisk interagerer med en nanostruktur. En bakteriecelle (blå) er indlejret i den hule nanopillers hul, og flere
Se først på, hvordan individuelle Staphylococcus-celler klæber til nanostrukturer, kan føre til …Dette scanningselektronmikroskopibillede afslører, hvordan Staphylococcus Aureus-celler fysisk interagerer med en nanostruktur. En bakteriecelle (blå) er indlejret i den hule nanopillers hul, og flere -
 En nano-golfbane til at samle præcist nanopartiklerFor at vise, hvor godt deres metode virker, forskerne producerede geometrisk komplekse strukturer ved at skrive alfabetet med nanopartikler - den mindste segmentskærm i verden. Kredit: Natur nanotekno
En nano-golfbane til at samle præcist nanopartiklerFor at vise, hvor godt deres metode virker, forskerne producerede geometrisk komplekse strukturer ved at skrive alfabetet med nanopartikler - den mindste segmentskærm i verden. Kredit: Natur nanotekno -
 Den direkte observation af van der Waals stablingsafhængig mellemlagsmagnetismeMolecular beam epitaxy (MBE) Vækst af CrBr3 monolag og dobbeltlag på HOPG (højt orienteret pyrolytisk grafit). (A og B) RHEED (refleksionshøj energi elektrondiffraktion) mønstre med angivne diffraktio
Den direkte observation af van der Waals stablingsafhængig mellemlagsmagnetismeMolecular beam epitaxy (MBE) Vækst af CrBr3 monolag og dobbeltlag på HOPG (højt orienteret pyrolytisk grafit). (A og B) RHEED (refleksionshøj energi elektrondiffraktion) mønstre med angivne diffraktio -
 Grundlæggende opdagelse kan føre til bedre hukommelseschipsI atomskala, Forskere fra University of Michigan har for første gang kortlagt polariseringen af et banebrydende materiale til hukommelseschips. Kredit:Chris Nelson og Xiaoqing Pan (PhysOrg.com)
Grundlæggende opdagelse kan føre til bedre hukommelseschipsI atomskala, Forskere fra University of Michigan har for første gang kortlagt polariseringen af et banebrydende materiale til hukommelseschips. Kredit:Chris Nelson og Xiaoqing Pan (PhysOrg.com)
- Et alt-i-et cyberværktøjssæt til kriminel efterforskning
- Frosset i tiden, rollebesætningen af indfødte australiere, der optrådte i menneskelige zoologis…
- NASA nattebilleder finder den tropiske storm Laura under udvikling
- Saturns strålingsbælter:En fremmed for solvinden
- En mulig måde at måle ældgammel hastighed af kosmiske stråler ved hjælp af paleo-detektorer
- Bransons Virgin Orbit opsender 7 satellitter fra 747 fly


