Temporal-spatial ordensegenskab for hule flerskallede strukturer muliggør sekventiel frigivelse af lægemidler
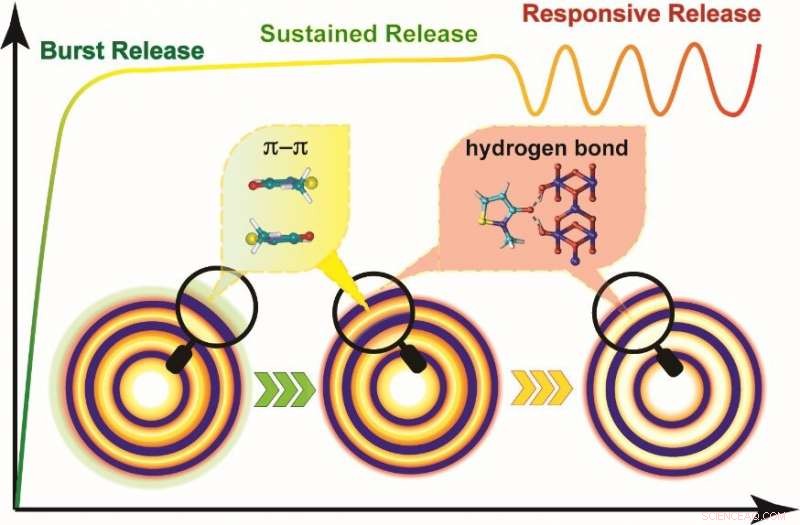
Skematisk illustration af den sekventielle lægemiddelfrigivelse ved hjælp af hul flerskallet struktur. Kredit:Yang Nailiang
Hule flerskallede strukturer (HoMS'er), med relativt isolerede hulrum og hierarkiske porer i skallerne, strukturelt ligner celler. De kan bruges som bærer for antibakterielle midler.
En nylig forskning ledet af prof. Wang Dan og prof. Zhang Suojiang fra Institute of Process Engineering (IPE) ved det kinesiske videnskabsakademi undersøgte diffusions- og transportmekanismen for antimikrobielle molekyler gennem HoMS'er, og opdagede, at HoMS'ers unikke tids-rumlige ordensegenskab kan realisere den sekventielle lægemiddelfrigivelse for første gang.
Denne forskning blev offentliggjort i Naturkommunikation den 7. sept.
"Vi syntetiserede TiO 2 -HoMS'er gennem sekventiel skabelontilgang, og introducerede antibakterielt middel Methylisothiazolinone (MIT) som modelmolekyler i HoMS'er, " sagde prof. Wang.
Ved at analysere adfærden af HoMS'er under frigivelse af lægemidler, forskerne opdagede, at frigivelsen af molekylerne fra HoMS'er gik gennem sekventielle frigivelsesstadier, nemlig burst release, vedvarende frigivelse, og stimulusresponsiv frigivelse.
I detaljer, ved blot at justere mængden af MIT-HoMS'er, der indføres i miljøet, den ønskede koncentration kan hurtigt nås i burst release-stadiet på grund af MIT-molekylerne absorberet på den ydre overflade af HoMS'er.
Den vedvarende frigivelse af MIT-molekyler i π-π stablet tilstand i hulrummet af HoMS'er kunne opretholde den nødvendige koncentration i en lang periode og hæmme væksten af bakterier.
Den tredobbelte HoMS kunne give en lang sterilitetsperiode i et bakterierigt miljø, der er næsten otte gange længere end det rene antimikrobielle middel under de samme forhold.
"Da de fremmede patogener blev tilføjet til vores HoMSs-system, drivkraften var stærk nok til at bryde energibarrieren, og lægemiddelmolekylerne lagret mellem skallerne og absorberet på overfladen blev frigivet, resulterer i den responsive udgivelse. Vigtigere, lægemiddelkoncentrationen kan genfindes til det ønskede område automatisk, " sagde prof. Wang.
På grund af forskellige adsorptionsegenskaber i HoMS'er og fysiske barrierer fra multishellerne, lægemiddelmolekyler på forskellige steder i HoMS'er har forskellige frigivelsestider.
Alle disse fordele kunne tilskrives kemisk diffusions- og fysisk barrieredrevet sekventiel lægemiddelfrigivelse, giver en rute for design af intelligente nanomaterialer.
 Varme artikler
Varme artikler
-
 Belysning af strukturelle egenskaber i Li-ion-batterier, der leverer ultrahurtig opladningTre katoder blev fremstillet:en standard blottet en (venstre), en belagt med et lag BaTiO 3 (midten), og en belagt med flere BaTiO 3 nanodotter (til højre). Den med nanodotter udviste stærkt forbe
Belysning af strukturelle egenskaber i Li-ion-batterier, der leverer ultrahurtig opladningTre katoder blev fremstillet:en standard blottet en (venstre), en belagt med et lag BaTiO 3 (midten), og en belagt med flere BaTiO 3 nanodotter (til højre). Den med nanodotter udviste stærkt forbe -
 Nye processer i moderne ReRAM-hukommelsesceller afkodetDannelse af metallisk tantal (Ta) filament i Ta/TaO(x)/Pt ReRAM hukommelsescelle. Positivt ladede Ta(5+)-ioner og ilttomheder (V(O)) bidrager til processen. Kredit:Forschungszentrum Jülich / RWTH Aach
Nye processer i moderne ReRAM-hukommelsesceller afkodetDannelse af metallisk tantal (Ta) filament i Ta/TaO(x)/Pt ReRAM hukommelsescelle. Positivt ladede Ta(5+)-ioner og ilttomheder (V(O)) bidrager til processen. Kredit:Forschungszentrum Jülich / RWTH Aach -
 Hydrogeneringsteknik tredobler transistorydelsen i epitaxial grafenOptisk billede af transistorer og strukturer til test af enhedens ydeevne på hydrogeneret epitaxial grafen. Kredit:Joshua Robinson, Penn State EOC (PhysOrg.com)-En teknik, der bruger hydrogen til
Hydrogeneringsteknik tredobler transistorydelsen i epitaxial grafenOptisk billede af transistorer og strukturer til test af enhedens ydeevne på hydrogeneret epitaxial grafen. Kredit:Joshua Robinson, Penn State EOC (PhysOrg.com)-En teknik, der bruger hydrogen til -
 Forskere åbner vejen for at bruge cellers egne nanopartikler som sygdomsbiomarkørerPh.D. studerende Sally Yunsun Kim arbejder på AFM-IR-enheden på Det Farmaceutiske Fakultet. Kredit:Louise Cooper/University of Sydney Forskere ved University of Sydney har etableret en metode til
Forskere åbner vejen for at bruge cellers egne nanopartikler som sygdomsbiomarkørerPh.D. studerende Sally Yunsun Kim arbejder på AFM-IR-enheden på Det Farmaceutiske Fakultet. Kredit:Louise Cooper/University of Sydney Forskere ved University of Sydney har etableret en metode til
- Antallet af australiere, der oplever boligstress, fordobles
- Hvordan man opbygger en mini-fan
- Tyskland giver Daimler deadline for at indsende rettelser til dieselvarebiler
- Holde det friskt:Ny AI-baseret strategi kan vurdere friskheden af oksekødsprøver
- Ny forskning kan forudsige La Nina tørke år i forvejen
- At fange molekylære dansebevægelser i slowmotion ved at tilføje hvid støj


