Real-time billeddannelse viser, hvordan SARS-CoV-2 angriber menneskelige celler
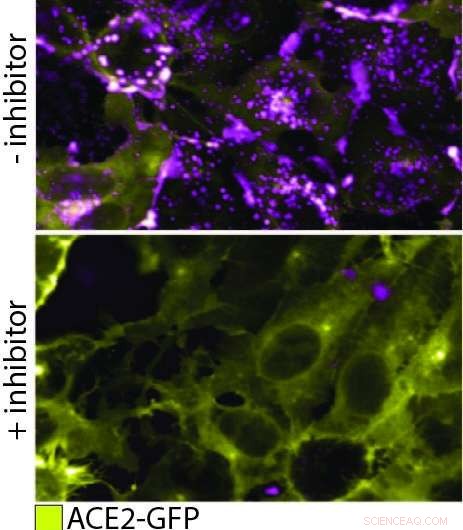
QD608-RBD binder ACE2 og inducerer endocytose. I denne figur, det øverste panel viser ACE2-GFP (gul) udtrykkende celler, der binder og internaliserer QD608-RBD (magenta). I det nederste panel, en inhibitor tilsættes for at forhindre binding af QD608-RBD til ACE2-GFP, og tilstedeværelsen af ACE2-GFP på celleoverfladen er stærk med lidt eller ingen synlig QD608-RBD. Kredit:NCATS
"Det, vi gør her, er faktisk at visualisere bindingen af spidsen til ACE 2 [angiotensinkonverterende enzym 2], " siger Kirill Gorshkov, en forsker ved National Center for Advancing Translational Sciences (NCATS) i Maryland, OS.
Selvom det lyder uskyldigt for den uindviede, denne binding er det første trin i en viral spredningsproces, der kan have ført til den værste pandemi i minde om. "Spike" er et protein på SARS-CoV-2-virussen, der er almindeligt anerkendt som det primære angrebsvåben til at mobilisere dets virale DNA ind i en værtscelle. ACE2-receptorerne er humane celleproteiner, der effektivt åbner døren for dette angreb. Brug af biokonstruerede kvanteprikker, Gorshkov og Eunkeu Oh ved Naval Research Laboratory (NRL) i Washington, D.C., og deres kolleger var i stand til at afbilde bindingen og den efterfølgende internalisering, der finder sted, når ACE2 og spikeproteinet interagerer. "Du kan faktisk se det ske i realtid, " tilføjer Gorshkov, "Det er det smukke ved denne analyse, og det er derfor, vi tror, det vil være vigtigt for lægemiddelscreening."
En virus kan ikke formere sig uden at tilmelde en værtscelle, så forskere over hele kloden har arbejdet på at forstå, hvordan SARS-CoV-2 interagerer med og trænger ind i celler med det formål at blokere denne fase og forhindre udbrud af COVID19. Gorshkov og hans kolleger hos NCATS arbejdede allerede på forskellige billeddiagnostiske assays for kræftsygdomme, vira og lysosomale lagringssygdomme, "men da coronavirus ramte, vi skulle hurtigt skifte gear, " siger Gorshkov.
Tidligere SARS-forskning havde fremhævet vigtigheden af interaktioner med ACE2 i humane celler for spredningen af denne type virus, og de var allerede i stand til at mærke disse receptorproteiner med et grønt fluorescerende protein for at afbilde deres bevægelser. Der blev også akkumuleret beviser for at identificere de specifikke spidsproteiner på SARS-CoV-2, der muligvis låser ACE2 ind i en højborg, så virussen kan trænge ind i cellen. Imidlertid, information om spike protein interaktioner er for det meste kommet indirekte fra biokemiske eller proximity assays og tests med proteiner og dele af proteiner taget fra virussen - "pseudo-viro-partikler." Uden fluorescerende mærkning af disse virale proteiner, deres rolle i ACE2-receptorbindingen og efterfølgende internalisering - endocytose - fortsatte med at udspille sig effektivt under dække af mørket til billeddannelse.
Hos NRL, forskere var også ivrige efter at udnytte deres ekspertise med nanopartikler til cellulær levering og biosensing for at hjælpe bestræbelserne på at søge efter anti-COVID19-lægemidler. Oh begyndte at undersøge mulige måder at anvende de protein-nanostruktur-konjugationsteknikker, hun havde arbejdet med i over 15 år. Med to proteiner, der deler en bindingsaffinitet - en kvanteprik knyttet til den ene og en fluorescerende nanopartikel bundet til den anden - vil binding mellem de to proteiner så bringe nanostrukturerne tæt nok til energioverførsel mellem dem.
Den resulterende fluorescensslukning giver derefter forskerne mulighed for at overvåge proteinbindingen. "Hvis du har en inhibitor i midten for at stoppe bindingen, dette kan bruges som et hæmningsassay til lægemiddelscreening, så vi bruger det meget, " forklarer Oh. Ser den potentielle anvendelse til screening af antistoffer mod COVID19, Oh og hendes team ledet af Mason Wolak præsenterede deres ideer for teamet på NCATS, og de to institutioner gik direkte i gang med at udvikle det yderligere.
Udvikling af et "pseudovirion"
Det første skridt fra Ohs side af samarbejdet var at udvikle et "pseudovirion" med de potente dele af SARS-CoV-2 spikeproteiner (hvor receptorbindingsdomænet er placeret) knyttet til kvanteprikken på en sådan måde, at spikeproteinerne fortsætte med at angribe og trænge ind i celler ligesom en aktiv virus. For det, orienteringen af spidsproteinerne og formen af pseudovirion var nøglen, og her, Ohs omfattende erfaring med at konjugere aktive proteiner til nanostrukturer gav pote. Før du går videre til de dyrere cellulære leveringstests, de skulle teste, om deres pseudovirion fungerede uden for cellerne ved at konjugere fluorescerende guldnanopartikler til ACE2-receptorerne og overvåge for fluorescensslukning. Oh lister de mange forhold mellem protein og kvanteprikker, kvanteprikstørrelser og overfladekemi, de prøvede, før de endelig var i stand til at observere fluorescensslukning på proteinbinding, og var klar til at sende pseudovirionen til Gorshkovs hold "for at lave seje ting med den rigtige celle."
For at observere pseudovirion interagere med ACE2 i en rigtig celle, kvanteprikken på pseudovirion skulle nu konstrueres til at udsende ved en bølgelængde, der var let at skelne fra det grønne fluorescerende protein på ACE2, i modsætning til optimering af nanopartikelslukning. Med de to klare signaler, holdet på NCATS kunne spore bindingen af de to proteiner og efterfølgende endocytose. Derudover de kunne se, at bindingen og endocytosen blev forhindret i nærvær af to testantistoffer. De kunne endda teste endocytosemekanismen, som fortsætter ved hjælp af et protein ved navn dynamin. Da de tilføjede Dyngo-4a, som afbryder dynamin, de kunne se bindingen finde sted, men ingen efterfølgende endocytose.
Resultaterne viser også en succes for fjernforskningssamarbejde, da holdene faktisk aldrig mødtes. "Den type samarbejde, vi har her, er sjælden, " siger Gorshkov, afspejler, hvor meget deres fremskridt oversteg tidligere samarbejder, hvor der havde været et større antal fysiske møder og koordinerede aktiviteter. "Der var sådan et drive og et sådant fokus fra begge grupper, at det virkelig gav en god synergi."
Quantum dot pseudovirion er begrænset til billeddannende cellepenetration ved endocytose, og det mangler at blive afgjort, om denne mekanisme træder i kraft for alle celletyper, især lungevæv. En alternativ SARS-CoV-2 angrebsmekanisme er baseret på membranfusion, og billeddannelse af dette med quantum-dot pseudovirion ville kræve betydelige modifikationer for at interagere med cellen mere som en membran. Imidlertid, den hurtige gennemstrømning og direkte observationer, som quantum-dot pseudovirion muliggør, bør udgøre betydelige fordele i søgningen efter antistoffer.
© 2020 Science X Network
 Varme artikler
Varme artikler
-
 Forskere laver plasmonisk papir til påvisning af kemikalier og biologisk vigtige molekylerEn håndtegning af Washington University logo ved hjælp af guld nanorods (AuNRs) og guld nanospheres (AuNPs) som plasmonisk blæk, hvor røde og grønne farver er resultatet af nanopatiklernes iboende opt
Forskere laver plasmonisk papir til påvisning af kemikalier og biologisk vigtige molekylerEn håndtegning af Washington University logo ved hjælp af guld nanorods (AuNRs) og guld nanospheres (AuNPs) som plasmonisk blæk, hvor røde og grønne farver er resultatet af nanopatiklernes iboende opt -
 Ny atomare lag-for-lag InGaN-teknologi giver gennembrud for solcelleeffektivitetAtomarrangementet ved en afslappet InGaN/GaN-grænseflade skabt af lag-for-lag atomkrystalvækst er vist. Teknikken kan pege på nye udviklinger inden for solcelleeffektivitet. Kredit:Arizona State Unive
Ny atomare lag-for-lag InGaN-teknologi giver gennembrud for solcelleeffektivitetAtomarrangementet ved en afslappet InGaN/GaN-grænseflade skabt af lag-for-lag atomkrystalvækst er vist. Teknikken kan pege på nye udviklinger inden for solcelleeffektivitet. Kredit:Arizona State Unive -
 Bilags grafen fungerer som en isolatorBilledet viser en diagram med to lag grafen. De blå perler repræsenterer carbonatomer. Kredit:Lau lab, UC Riverside Et forskerhold ledet af fysikere ved University of California, Riverside har ide
Bilags grafen fungerer som en isolatorBilledet viser en diagram med to lag grafen. De blå perler repræsenterer carbonatomer. Kredit:Lau lab, UC Riverside Et forskerhold ledet af fysikere ved University of California, Riverside har ide -
 Plankton inspirerer til skabelse af stealth-panser til mikroskopiske lægemiddelkøretøjer med lang…Fire forskellige rustningstyper tilføjet af forskerne fra University of Warwick (PhysOrg.com) -- Nogle former for plankton og bakteriers evne til at bygge et ekstra naturligt lag af nanopartikelli
Plankton inspirerer til skabelse af stealth-panser til mikroskopiske lægemiddelkøretøjer med lang…Fire forskellige rustningstyper tilføjet af forskerne fra University of Warwick (PhysOrg.com) -- Nogle former for plankton og bakteriers evne til at bygge et ekstra naturligt lag af nanopartikelli
- DNA Lego klodser muliggør hurtig genskrivbar datalagring
- Gadgets:Forkæl dine perlehvide med en sonisk rengøring
- Ikke alle privatlivsapps er skabt lige
- 5.8 jordskælv rasler Rumænien, mærkes i Ukraine, andre steder
- Vedvarende energimandater reducerer kuldioxidemissioner - men for en pris
- Marooned på Mesozoic Madagaskar:Forskere opdager 66 millioner år gammelt skørt udyr


