Forskning viser, at celleforstyrrelsessystem kan have medicinske anvendelser
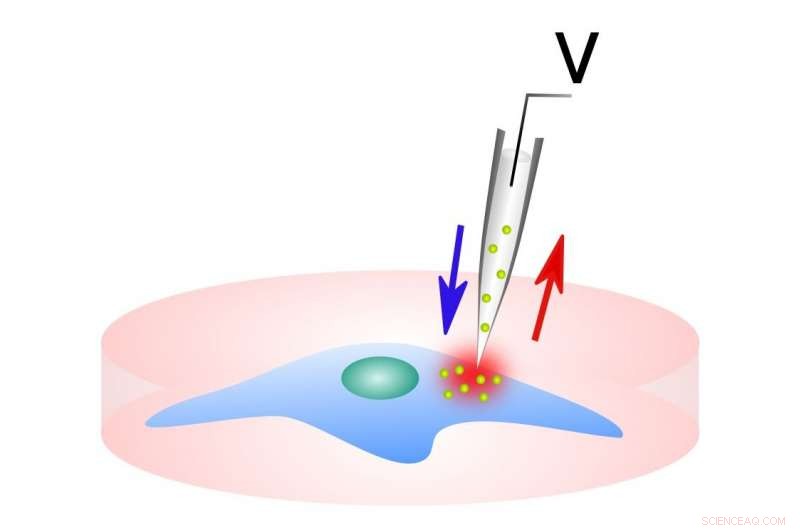
Dette billede viser leverings-/prøveudtagningssystemet. Kredit:Northwestern McCormick School of Engineering
Cellelinjer injiceret med fri nukleinsyre anvendes i vid udstrækning til lægemiddelopdagelse og sygdomsmodellering. For at undgå genetisk blandede cellepopulationer, efterforskere bruger fortyndingsteknikker til at udvælge enkelte celler, som derefter vil generere identiske linjer. Imidlertid, ruten til at begrænse fortyndinger er kedelig og tidskrævende.
En ny undersøgelse fra nordvestlige forskere viser, hvordan Nanofountain Probe Electroporation (NFP-E), et værktøj, der leverer molekyler ind i enkeltceller, kunne løse det problem, og kan føre til nye applikationer til lægemiddelscreening og udformning af patientspecifikke behandlingsforløb.
Holdet, ledet af Northwestern Engineerings Horacio Espinosa og inklusive Joshua Leonard, demonstrerer alsidigheden af NFP-E - som introducerer DNA eller RNA i celler ved hjælp af elektricitet. Det kan også levere både proteiner og plasmider i en række forskellige dyre- og humane celletyper med dosiskontrol. Holdet omfattede John Kessler, Ken og Ruth Davee professor i stamcellebiologi og professor i neurologi og farmakologi ved Northwestern University Feinberg School of Medicine.
Den nye metode kan bruges til at studere sygdom eller til celleterapi. I den tidligere, genomet manipuleres. I sidstnævnte, Genredigering forekommer i celler såsom T-celler for at behandle kræft med immunterapier.
Ved at anvende encellet elektroporation, processen med at indføre DNA eller RNA i enkelte celler ved hjælp af en puls af elektricitet, som kortvarigt åbner porerne i cellemembranen, deres arbejde viser, hvordan NFP-E opnår fin kontrol over den relative ekspression af to co-transficerede plasmider. I øvrigt, ved at parre enkeltcellet elektroporation med time-lapse fluorescerende billeddannelse, deres undersøgelse afslører karakteristiske tider for elektroporelukning.
Prøveudtagningen før elektroporation. Kredit:Northwestern McCormick School of Engineering
"Vi demonstrerede potentialet i NFP-E-teknologien til at manipulere en række celletyper med støkiometrisk kontrol af molekylær last, der kan bruges til at udføre en bred vifte af undersøgelser inden for lægemiddelscreening, celleterapi, og syntetisk biologi, " sagde Espinosa, James N. og Nancy J. Farley Professor i fremstilling og entreprenørskab og professor i maskinteknik og (ved høflighed) biomedicinsk teknik og civil- og miljøteknik.
I øjeblikket, biomolekyler kan leveres ind i celler på adskillige måder:virale vektorer; kemiske bærere, såsom cellegennemtrængende peptider og polymer nano-kapsler; lipofektamin, og bulkelektroporation.
"Der findes en række strategier til at levere biomolekyler ind i celler, men hver har sine begrænsninger, " sagde Leonard, lektor i kemisk og biologisk ingeniørvidenskab og Charles Deering McCormick professor i undervisningskvalitet. "For eksempel, kemiske bærere giver relativt langsom levering og kan være toksiske for cellen; virale vektorer er ofte effektive, men kan inducere ugunstige immunreaktioner og insertions genotoksicitet. Brug af enhver traditionel metode kræver ofte en betydelig indsats for at optimere protokollen afhængigt af celletypen og molekylet, der skal leveres, og, derfor, en let generaliserbar biomolekyleleveringsstrategi ville give nogle meningsfulde fordele."
Det nye NFP-E system muliggør enkeltcellet levering af DNA, RNA, og proteiner ind i forskellige udødelige cellelinjer såvel som primære celler med mere end 95 procent effektivitet og mere end 90 procent cellelevedygtighed.
"Resultaterne indikerer, at cellemembranens genforseglingstid skalerer ikke-lineært med pulsspændingen og antallet af elektroporationsimpulser, når et maksimum ved mellemværdier, " sagde Espinosa. "Det betyder, at lange pulseringstider eller høje spændinger ikke ser ud til at være nødvendige for effektiv molekylær transport over cellemembraner. Denne funktion er vigtig for at opnå høj transporteffektivitet, samtidig med at celletoksicitet holdes på et minimum."
Prøveudtagningen efter elektroporation. Kredit:Northwestern McCormick School of Engineering
Ved hjælp af encellet elektroporationsteknologi, forskerne var i stand til at forstå transportmekanismer involveret i lokaliseret elektroporationsbaseret celleprøvetagning. En hindring for ikke-destruktiv tidsmæssig enkeltcelleprøvetagning er de små mængder cytosol - væsken inde i cellerne - der udvindes, hvilket gør det udfordrende at teste eller påvise RNA-sekvenser eller proteiner.
Forskning viste, at skaleringen af membrangenforseglingstid er en funktion af forskellige elektroporationsparametre, giver indsigt i post-puls elektro-pore dynamik.
"Arbejdet adresserer behovet for at forstå måder at øge den cytosol-prøvede mængde på, uden at påvirke cellerne negativt, " sagde Espinosa. "Det kan guide forskersamfundet i at designe eksperimenter rettet mod elektroporationsbaseret prøveudtagning af intracellulære molekyler til tidscelleanalyse."
Denne forskning er relateret til tidligere arbejde, der udviklede en minimalt invasiv metode til at prøve celler, som kan gentages flere gange. Den tidligere undersøgelse, som brugte elektriske impulser til at udtrække enzymer fra cytosolen, assisteret forståelse af kinetikken af poredannelse og lukning.
Papiret, "Nanofountain Probe Electroporation Enables Versatile Single-Cell Intracellular Delivery and Investigation of Postpulse Electropore Dynamics" blev offentliggjort 2. oktober i tidsskriftet Lille .
 Varme artikler
Varme artikler
-
 Indfangning af levende celler i mikropyramiderChondrocyt fanget inde i en mikropyramide, interagere med sine naboer. En mark fuld af pyramider, men i mikroskala. Hver af pyramiderne skjuler en levende celle. Takket være 3D-fremstilling i mikr
Indfangning af levende celler i mikropyramiderChondrocyt fanget inde i en mikropyramide, interagere med sine naboer. En mark fuld af pyramider, men i mikroskala. Hver af pyramiderne skjuler en levende celle. Takket være 3D-fremstilling i mikr -
 Mindsker magnetismen af metalliske kernepartikler med en metal-organisk ramme skalMagnetstyrken (til venstre) falder, når magnetiske jernmikrosfærer (sort) er pakket ind i en metal-organisk ramme (blå). Kredit:Nathan Johnson, PNNL Overflademinedrift for sjældne jordarter, der b
Mindsker magnetismen af metalliske kernepartikler med en metal-organisk ramme skalMagnetstyrken (til venstre) falder, når magnetiske jernmikrosfærer (sort) er pakket ind i en metal-organisk ramme (blå). Kredit:Nathan Johnson, PNNL Overflademinedrift for sjældne jordarter, der b -
 Forberedelse af anti-tumor nanopartikler ved hjælp af tigermælksvampEt polysaccharid-protein kompleks blev fundet i Tiger Milk svampe fra Afrika, som kan gøre selen til ny kræftbehandling. Copyright:Hong Kong Polytechnic University At udnytte kraften i naturlige i
Forberedelse af anti-tumor nanopartikler ved hjælp af tigermælksvampEt polysaccharid-protein kompleks blev fundet i Tiger Milk svampe fra Afrika, som kan gøre selen til ny kræftbehandling. Copyright:Hong Kong Polytechnic University At udnytte kraften i naturlige i -
 Strækbar, fleksibel, pålidelig hukommelsesenhed inspireret af hjernenSammenligning mellem synapsen og den to-terminale tunneling random access memory (TRAM). I forbindelsespunkterne (synapserne) mellem neuroner, signaler overføres fra en neuron til den næste. TRAM er l
Strækbar, fleksibel, pålidelig hukommelsesenhed inspireret af hjernenSammenligning mellem synapsen og den to-terminale tunneling random access memory (TRAM). I forbindelsespunkterne (synapserne) mellem neuroner, signaler overføres fra en neuron til den næste. TRAM er l
- Hvordan hjemløse kvinder ikke har andet valg end at bruge sex for at overleve
- Foxconn vælger selskab med tætte bånd til Walker
- Hvad er forskellen mellem et nukleotid og et nucleosid?
- Iran flytter for at redde sidste maskot asiatiske geparder
- Det er årstiden for at være på vagt:Risiko for chokoladeforgiftning hos hunde topper i julen
- Den atlantiske cirkulation kollapser ikke - men når den skifter gear, opvarmningen vil accelerere i…


