Forskere slår opløsningsrekorder for at visualisere individuelle atomer med enkelt-partikel cryo-EM
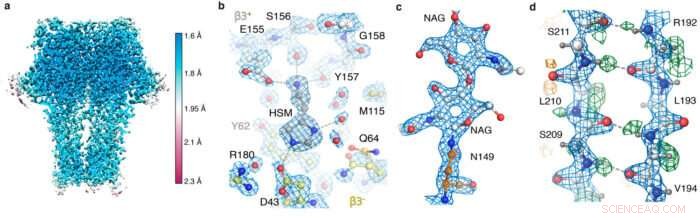
GABA EN receptor kort øjebliksbilleder. (a) lokal løsning; (b) agonistlommen viser histaminkoordination og vandmolekyler; (c) N-bundet glycan; (d) hydrogenbindingsnetværk afsløret af forskelskortet (grønne toppe).
At se på det præcise tredimensionelle arrangement af atomer i et protein hjælper os med at forstå, hvordan det kan udføre sine funktioner. Selvom elektronkryo-mikroskopi (cryo-EM) har udviklet sig hurtigt som en vigtig strukturel biologiteknik i de senere år, Røntgenkrystallografi havde været den eneste teknik, der var i stand til at visualisere individuelle atomer. Radu Aricescus og Sjors Scheres' grupper på MRC Laboratory of Molecular Biology, i samarbejde med forskere hos Thermo Fisher Scientific og andre steder, har nu været i stand til at opløse individuelle proteinatomer for første gang i et tredimensionelt kryo-EM billede.
Dette samarbejde startede i begyndelsen af 2019, da Radu og Abhay Kotecha, en forsker ved Thermo Fisher Scientific, ønskede at teste ny cryo-EM hardware på en lille membranproteinprøve. GABAA receptorer, et fokus for Radus forskning i over et årti, blev valgt, fordi den højest opnåelige opløsning ved brug af den bedste tilgængelige teknologi så ud til at have nået en grænse på omkring 2,5 Ångströms (Å), men højere opløsning var klart nødvendig for bedre lægemiddeldesign.
Hvad er atomopløsning?
Opløsning rapporteres normalt i Ångströms, en længdeenhed, der er en ti-milliard af en meter eller 0,1 nanometer, og refererer til den mindste afstand, mellem hvilken to objekter kan ses at være adskilte.
Længden af en typisk carbon-carbon-binding er 1,5 Å; andre bindinger i proteiner er lidt kortere. Dermed, da opløsningen kommer ned til 1,2 Å, det bliver muligt at se individuelle atomer i et protein, opnå ægte atomopløsning.
Mens man testede ny hardwareudvikling, der inkluderede en koldfeltemissions-elektronkilde, et nyt energifilter, og et nyt kamera, holdet skulle også udvikle nye behandlingsstrategier. Algoritmer til korrektion af optiske aberrationer, som tidligere blev udviklet af Jasenko Zivanov i Sjors' gruppe, samt en algoritme foreslået af Chris Russo og Richard Henderson, spillet en afgørende rolle i at presse mest mulig information ud af billederne.
Efter at have modtaget billeder indsamlet på den nye mikroskophardware af Abhay Kotecha hos Thermo Fisher Scientific i Eindhoven, Holland, Takanori Nakane, en postdoc i Sjors gruppe, udviklet en optimal arbejdsgang i RELION og Andrija Sente, sammen med andre medlemmer af Radus gruppe, brugte denne arbejdsgang til at behandle GABAA-receptorbilleder, mens resultaterne tilbageføres for hurtigt at optimere mikroskopindstillingerne. En ny, datalagringssystem med høj kapacitet udviklet af Jake Grimmett og Toby Darling i LMB's Scientific Computing-team tilbød afgørende støtte til at håndtere de omkring hundrede terabyte data, der blev genereret. Denne vedvarende teamindsats førte til en hidtil uset 1,7 Å opløsning GABAA-receptorstruktur.
Dette var den bedst rapporterede opløsning opnået ved anvendelse af cryo-EM for enhver anden proteinprøve end for proteinet apoferritin. Apoferritin bruges almindeligvis som benchmark for cryo-EM, fordi dens molekylære stabilitet og 24-fold symmetri tillader højopløsningsrekonstruktioner fra relativt få partikler.
Ved at bruge den nye hardware og behandlingsstrategier, holdet var i stand til at opnå en 1,22 Å opløsning af apoferritin struktur, slog den tidligere rekord på 1,53 Å for at være den højeste opløsning af enkelt-partikel cryo-EM struktur, der endnu er opnået. Mest imponerende, denne opløsning muliggjorde visualisering af individuelle brintatomer, selv på vandmolekyler inde i proteinstrukturen. Visualiseringen af hydrogenbindingsnetværk inde i proteinstrukturer og i lægemiddelbindingslommer giver forskere mulighed for bedre at forstå, hvordan de virker.
Dette arbejde repræsenterer brydningen af en nøglebarriere for cryo-EM som en strukturel biologiteknik og den nye teknologi, dataindsamling, og behandlingsstrategier vil udvide antallet af proteiner, hvis strukturer kan løses til høj opløsning. Disse rekonstruktioner med højere opløsning vil give en bedre forståelse af, hvordan proteiner virker, og lette design af mere specifikke lægemidler, der kan påvirke behandlinger for en lang række sygdomme.
Sidste artikelGør streetwear til solenergianlæg
Næste artikelMed innovative nanofibermembraner, stofmaskers effektivitet går op til 99%
 Varme artikler
Varme artikler
-
 Brug af nanotråde til at bygge helt optiske logiske porteStrukturelle og optiske egenskaber ved InP og AlGaAs tværgående NW -netværk. (A) Falsk-farve scanning elektronmikroskopi billede af tværstangen InP og AlGaAs NW netværk (illustreret med forskellige fa
Brug af nanotråde til at bygge helt optiske logiske porteStrukturelle og optiske egenskaber ved InP og AlGaAs tværgående NW -netværk. (A) Falsk-farve scanning elektronmikroskopi billede af tværstangen InP og AlGaAs NW netværk (illustreret med forskellige fa -
 Forskere lærer at styre grafen med lasereBillede af Michael Sentef, Max Planck Institut for materiens struktur og dynamik. Nye numeriske simuleringer af Berkeley Lab Alvarez Fellow Alexander Kemper og hans kolleger ved Stanford Universit
Forskere lærer at styre grafen med lasereBillede af Michael Sentef, Max Planck Institut for materiens struktur og dynamik. Nye numeriske simuleringer af Berkeley Lab Alvarez Fellow Alexander Kemper og hans kolleger ved Stanford Universit -
 Konstruerede nanobodies blokerer SARS-CoV-2 fra at inficere menneskelige cellerForskere designede et tredelt molekyle (lyserødt), der putter sig ind i coronavirus-spidsproteinet (blåt), fastgøre det til en konformation, der gør det ude af stand til at holde sig til ACE2, recepto
Konstruerede nanobodies blokerer SARS-CoV-2 fra at inficere menneskelige cellerForskere designede et tredelt molekyle (lyserødt), der putter sig ind i coronavirus-spidsproteinet (blåt), fastgøre det til en konformation, der gør det ude af stand til at holde sig til ACE2, recepto -
 Grafen quantum dot LED'erElektroluminescerende billeder af GQD-LEDer (venstre) og luminescenseffektivitet af GQD-LEDer (højre). Kredit:KAIST De første grafen kvanteprikker lysemitterende dioder (GQD-LEDer), fremstillet ve
Grafen quantum dot LED'erElektroluminescerende billeder af GQD-LEDer (venstre) og luminescenseffektivitet af GQD-LEDer (højre). Kredit:KAIST De første grafen kvanteprikker lysemitterende dioder (GQD-LEDer), fremstillet ve
- Hvordan stemmeassistenter følger uhørbare kommandoer
- Kombination af silicium med et optisk aktivt materiale muliggør små lasere til industrien
- Oprydning af giftige steder bør ikke rydde ud af naboerne
- Geografer finder et vendepunkt i skovrydning
- Brug af katalysatorer som en pincet til at vælge en enkelt enantiomer fra et spejlet par
- At vokse op i en bankørken har store omkostninger


