Designede proteiner samler antistoffer i modulære nanocages
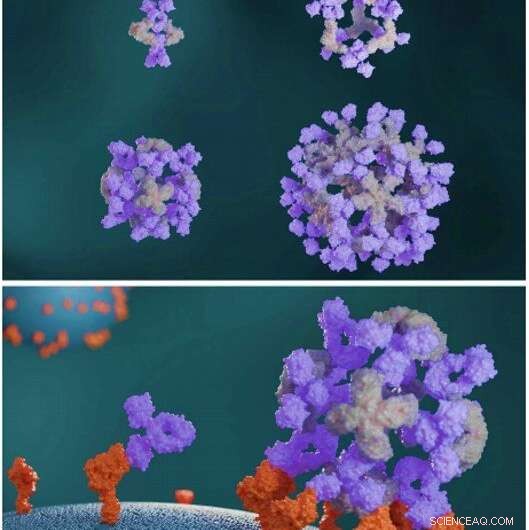
Designede proteiner samler antistoffer i store symmetriske arkitekturer. Designede antistofklyngeproteiner (lysegrå) samler antistoffer (lilla) til forskellige nanocage-arkitekturer (øverst). Antistof-nanocages forbedrer cellesignalering sammenlignet med frie antistoffer (nederst). Kredit:Videnskab, doi:10.1126/science.abd9994
I en ny rapport, der nu er offentliggjort den Videnskab , Robby Divine og et tværfagligt forskerhold ved Institut for Biokemi, regenerativ medicin, og vacciner og infektionssygdomme ved University of Washington U.S. og School of Medicine, ved Teheran University of Medical Sciences, Iran, udført beregningsmæssige design af nanocages for at samle antistoffer til præcise arkitekturer. Under byggeriet, en strukturel komponent dannede et antistof eller Fc-ligandfusion, og det andet design dannede en antistofbindende homo-oligomer til at drive nanocage-samling med forskellige valenser og symmetri. Holdet antager, hvordan denne proces også kan øge neutraliseringen af et pseudovirus; alvorligt akut respiratorisk syndrom coronavirus-2 (SARS-COV-2) via α-SARS-COV-2 monoklonale antistoffer og Fc-angiotensin-konverterende enzym 2 (ACE-2) fusionsproteiner.
Antistoffer i medicinsk forskning
Antistoffer, der specifikt binder til mål af interesse, spiller en central rolle i biomedicinsk forskning og medicin. Forskere kan generere klynger af antistoffer ved genetisk at forbinde antistoffragmenter sammen for at forbedre signaleringen. Det er i øjeblikket vanskeligt at danne antistofsamlinger med en række præcise arkitekturer og valenser. I dette arbejde, Divine et al. beregningsmæssigt designede proteiner, der samlede antistoffer til præcise arkitekturer med forskellige valenser og symmetrier. Holdet antog, at sådanne designs robust kunne drive vilkårlige antistoffer ind i homogene og strukturelt veldefinerede nanocages for udtalte effekter på cellesignalering. Forskerne designet proteiner til at drive samlingen af vilkårlige antistoffer til symmetriske samlinger med veldefinerede strukturer. For det, de fusionerede stift sammen tre typer "byggesten"-enheder indeholdende antistof Fc-bindende domæner, spiralformede gentagelseskonnektorer og cykliske oligomerdannende moduler. I sin arkitektur, den Fc-bindende enhed placerede sig med C2-antistofdimeren, den cykliske homo-oligomer dannede den anden cykliske symmetriakse i nanocage, og den spiralformede gentagelseskonnektor forbandt antistof- og cykliske homo-oligomer-symmetriakser i den korrekte orientering for at danne antistof-nanocages, der omtales som AbC'erne.
Antistof nanocage (AbC) design. (A) Polyhedral geometri er specificeret. Med uret fra øverst til venstre:icosahedral, dihedral, oktaedral, og tetraedriske geometrier er vist. (B) En antistof Fc-model fra hIgG1 er justeret til en af C2-akserne (i dette tilfælde, en D2 dihedron er vist). (C) Antistof Fc-bindere fusioneres til spiralformede gentagelsesforbindelser, der derefter fusioneres til den monomere underenhed af spiralformede cykliske oligomerer. Alle kombinationer af byggeklodser og byggeklodsforbindelser er samplet (gråfarvet bundindsats; tal i parentes henviser til antallet af tilgængelige byggeklodser). (D) Trepartsfusioner kontrolleres for at sikre en vellykket justering af C2 Fc-symmetriakserne med den for den polyedriske arkitektur (i tilfælde af D2-symmetrien vist her, C2-akserne skal skære hinanden i en vinkel på 90°). (E) Fusioner, der opfylder de geometriske kriterier, bevæger sig fremad med sidekædens redesign, hvor, for eksempel, aminosyrer er optimeret for at sikre, at kernepakningsrester er upolære og tætpakket, og at opløsningsmiddeleksponerede rester er polære. (F) Designede AbC-dannende oligomerer udtrykkes bakterielt, renset, og samlet med antistof Fc eller IgG. Kredit:Videnskab, doi:10.1126/science.abd9994 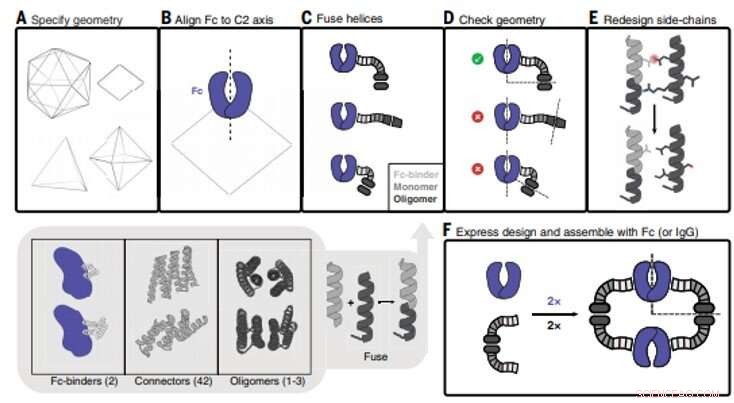
For at danne antistofbur (AbC)-design, Divine et al. stift fusionerede antistof konstante domæne-bindende molekyler til cykliske oligomerer under anvendelse af spiralformede spacer-domæner. De lettede processen gennem spiralformede spacer-domæner, så symmetriakserne af det dimere antistof og den cykliske oligomer kunne være i orienteringer, der genererede forskellige dihedrale eller polyedriske arkitekturer. Forskerne optimerede krydsningsområderne mellem de forbundne byggeklodser for at folde til de designede strukturer. Fusionstilgangen byggede på store sæt byggeklodser med mange mulige fusionssteder pr. byggeblok som stringente geometriske kriterier for at danne den ønskede symmetriske arkitektur. Holdet brugte en beregningsmetode til antistofburdesign til at generere dihedral, tetraedrisk, octahedral og icosahedral AbC'er og brugte en navnekonvention til at beskrive de endelige nanocage-arkitekturer. Divine et al. derefter udtrykte syntetiske gener, der koder for designs i bakteriekulturer af Escherichia coli. For eksempel, de succesfulde designs inkluderede D-2 decahedral (tre designs), T-32 (et design) og 152 icosahedral (to designs) arkitekturer indeholdende to, seks, 12 eller 30 antistoffer, henholdsvis. De karakteriserede Fc AbC'erne ved hjælp af småvinklet røntgenspredning og elektronmikroskopi. De rekonstruerede nanocages var i tæt overensstemmelse med de beregningsmæssige designmodeller. For at vurdere stabiliteten af nanocages, Divine et al. brugte dynamiske lysspredningsaflæsninger for at opnå opmuntrende stabilitet for derefter at muliggøre karakterisering af deres biologiske påvirkning.
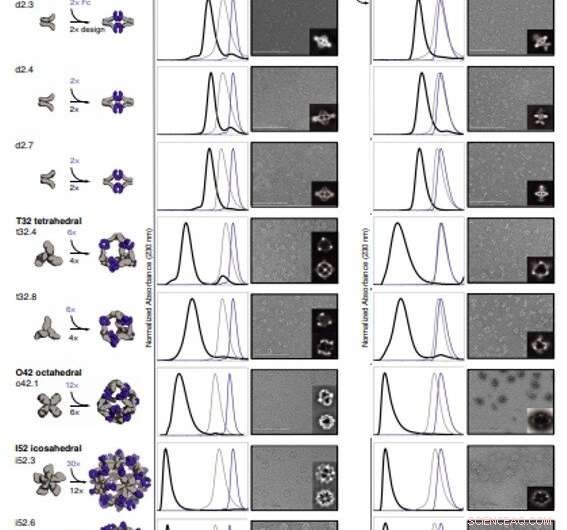
Strukturel karakterisering af AbC'er. (A) Design modeller, med antistof Fc (lilla) og designet AbC-dannende oligomerer (grå). (B) Overlejring af repræsentative SEC-spor af samling dannet ved at blande design og Fc (sort) med de enkelte komponenter i gråt (design) eller lilla (Fc). (C) EM-billeder med referencefrie 2D-klassegennemsnit i indsat; alle data er fra NS-EM, med undtagelse af design o42.1 og i52.3 (cryo-EM). (D og E) SEC (D) og NS-EM repræsentative mikrofotografier med referencefrie 2D-klassegennemsnit (E) af de samme designede antistofbure samlet med fuld human IgG1 (med de 2 Fab-regioner intakte). I alle EM-tilfælde vist i (C) og (E), samlinger blev først renset via SEC, og fraktionerne svarende til toppen længst til venstre blev poolet og brugt til billeddannelse for at fjerne overskydende design eller Ig-komponent. Skala barer, 200 nm. Kredit:Videnskab, doi:10.1126/science.abd9994
Effekter på cellesignalering
De designede AbC'er gav en generel platform til at forstå effekten af valens og geometri af receptorengagement på signalvejsaktivering. Den brede vifte af receptorbindende antistoffer og naturlige ligander dannet med AbC-metoden udviklet i dette arbejde muliggjorde klar og systematisk sondering af effekten af geometri og valens af receptorunderenhedsassociation på cellesignalering for næsten enhver vej. For at udforske det praktiske ved denne tilgang, Divine et al. samlede antistoffer eller Fc-ligandfusioner rettet mod en række signalveje ind i antistofbure (AbC'er) og undersøgte deres indvirkning på signalering. For eksempel, AbC'erne, dannet med et dødsreceptor-målrettet antistof induceret apoptose (celledød) af tumorcellelinjer, som hidtil var forblevet upåvirket af det opløselige antistof eller den native ligand. Ud over, samling af Fc-fusioner eller antistoffer i AbC'er, tilladt forbedret signalering af angiopoietinveje, CD-40-signalering og T-celleproliferation. AbC-dannelsen tillod yderligere neutralisering af et in vitro-pseudovirus, såsom alvorligt akut respiratorisk syndrom coronavirus 2.
3D-rekonstruktioner af AbC'er dannet med Fc. Beregningsmæssige designmodeller (tegneserierepræsentation) af hver AbC passer ind i den eksperimentelt bestemte 3D-densitet fra EM. Hver nanocage ses langs en ledig symmetriakse (venstre) og roteres for at se ned ad en af C2-symmetriakserne optaget af Fc (højre). Tredimensionelle rekonstruktioner fra o42.1 og i52.3 er fra kryo-EM-analyse, alle andre er fra NS-EM. Kredit:Videnskab, doi:10.1126/science.abd9994 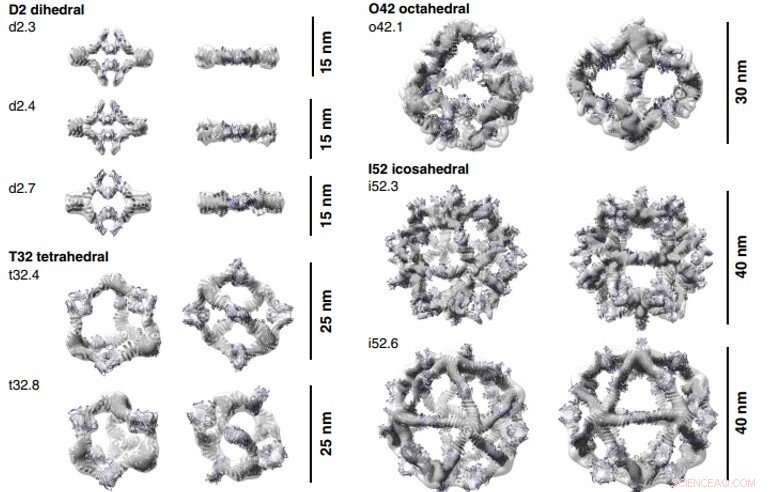
Metoden beskrevet i dette arbejde, gik ud over tidligere beregningsbestræbelser for at skabe protein nanomaterialer, der integrerer form og funktion. AbC'erne brugte derfor antistoffer som både strukturelle og funktionelle komponenter for at opnå en bred vifte af geometrier og orienteringer. Denne strategi er anvendelig til at designe vacciner med nanocages samlet med virale glycoproteiner ved hjælp af komponenter, der slutter i glycoproteinbindingsdomæner for at maksimere nærheden af aktive steder. På denne måde Robby Divine og kolleger designede flere antistof-burdannende proteiner til nøjagtigt at gruppere ethvert proteinbindende antistof i nanocages gennem kontrolleret valens og geometri. Holdet brugte to, seks og 12 eller 30 antistoffer i AbC'erne ved blot at blande antistoffet med det tilsvarende designede protein uden yderligere kovalente modifikationer. Forskerne tilføjede receptorbindende eller virusneutraliserende antistoffer til ABC'er for at øge deres biologiske aktivitet på tværs af forskellige cellesystemer. Holdet forventer, at dette resultat for hurtig antistofsamling inden for bestilte nanocages uden kovalente modifikationer vil have brede anvendelser på tværs af forskning og medicin.

AbC'er aktiverer apoptose og angiogenese signalveje. (A og B) Caspase-3/7 aktiveres af AbC'er dannet med a-DR5-antistof (A), men ikke det frie antistof, i RCC4 nyrekræftceller (B). (C og D) a-DR5 AbCs (C), men ikke Fc AbC kontroller (D), reducere cellernes levedygtighed 4 dage efter behandlingen. (E) a-DR5 AbC'er reducerer levedygtigheden 6 dage efter behandling. (F og G) o42.1 a-DR5 AbC'er øger PARP-spaltning, en markør for apoptotisk signalering; (G) er en kvantificering af (F) i forhold til PBS-kontrol. (H) The F-domain from angiopoietin-1 was fused to Fc (A1F-Fc) and assembled into octahedral (o42.1) and icosahedral (i52.3) AbCs. (I) Representative Western blots show that A1F-Fc AbCs, but not controls, increase pAKT and pERK1/2 signals. (J) Quantification of (I):pAKT quantification is normalized to o42.1 A1F-Fc signaling (no pAKT signal in the PBS control); pERK1/2 is normalized to PBS. (K) A1F-Fc AbCs increase vascular stability after 72 hours. (Left) Quantification of vascular stability compared with PBS. (Right) Representative images; scale bars, 100 mm. All error bars represent means ± SEM; means were compared using analysis of variance and Dunnett post-hoc tests (tables S8 and S9). *P ≤ 0.05; **P ≤ 0.01; ***P ≤ 0.001; ****P ≤ 0.0001 Credit:Science, doi:10.1126/science.abd9994
© 2021 Science X Network
 Varme artikler
Varme artikler
-
 En ny dimension for integrerede kredsløb:3-D nanomagnetisk logikStephan Breitkreutz og teamet bruger dette selvbyggede måleinstrument til at undersøge nanomagnetiske enheders koblingsadfærd. Kredit:U. Benz/TUM Elektriske ingeniører ved det tekniske universitet
En ny dimension for integrerede kredsløb:3-D nanomagnetisk logikStephan Breitkreutz og teamet bruger dette selvbyggede måleinstrument til at undersøge nanomagnetiske enheders koblingsadfærd. Kredit:U. Benz/TUM Elektriske ingeniører ved det tekniske universitet -
 Forskere bruger DNA origami -trick til at oprette 2D -strukturerForskere ved NYU og University of Melbourne har udviklet en metode ved hjælp af DNA origami til at omdanne endimensionelle nanomaterialer til to dimensioner. Deres gennembrud giver mulighed for at for
Forskere bruger DNA origami -trick til at oprette 2D -strukturerForskere ved NYU og University of Melbourne har udviklet en metode ved hjælp af DNA origami til at omdanne endimensionelle nanomaterialer til to dimensioner. Deres gennembrud giver mulighed for at for -
 Forskere afslører mekanisme til at skaffe metal nanoskruer3D-visualiseringer (opnået ved elektron-tomografi) af guldnanopartikler med kemisk dyrkede kvasi-spiralformede (chirale) funktioner, som giver dem en ejendommelig evne til at interagere med cirkulært
Forskere afslører mekanisme til at skaffe metal nanoskruer3D-visualiseringer (opnået ved elektron-tomografi) af guldnanopartikler med kemisk dyrkede kvasi-spiralformede (chirale) funktioner, som giver dem en ejendommelig evne til at interagere med cirkulært -
 Langsom brug af antibakteriel nanosølv er en resistensrisikoKredit:University of Technology, Sydney Forskere ved University of Technology Sydney advarer om, at sølvets bredspektrede antimikrobielle effektivitet bringes i fare ved den udbredte og upassende
Langsom brug af antibakteriel nanosølv er en resistensrisikoKredit:University of Technology, Sydney Forskere ved University of Technology Sydney advarer om, at sølvets bredspektrede antimikrobielle effektivitet bringes i fare ved den udbredte og upassende
- Hvordan man laver sjov hjemmelavede Spider Traps
- SureFly holder fokus på en ny dag i sikker, to-sæders fly
- At bringe en skjult superledende tilstand frem i lyset
- Efter en nulstilling, Nysgerrigheden fungerer normalt
- Fraktal plantemønstre giver optimale høst, uden central kontrol
- Hvad bruges printkort til?


