Forskere bruger multivalente guld nanopartikler til at udvikle effektiv molekylær sonde
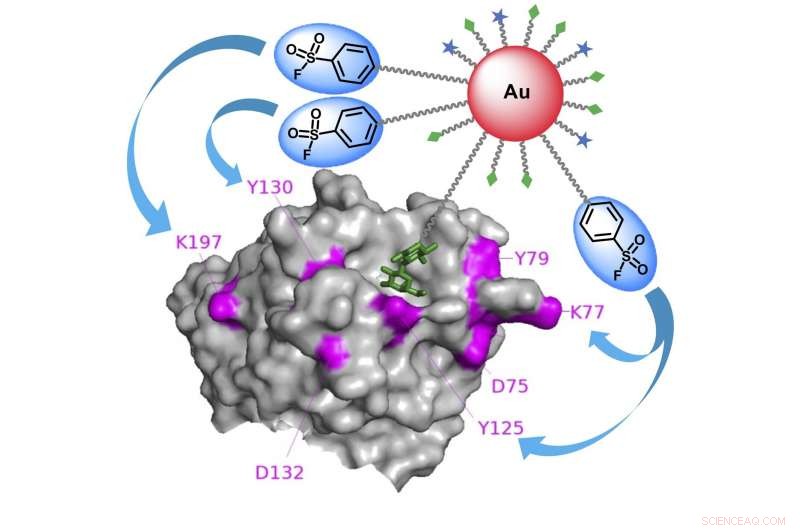
Grafisk abstrakt, som den guld-nanopartikel-baserede affinitetsmærkning til identifikation af specifikke kulhydratbindende proteiner. Kredit:Kaori Sakurai/ TUAT
Celler spiller et præcist spil telefon, at sende beskeder til hinanden, der udløser handlinger længere fremme. Med tydelige signaler, cellerne når deres mål. Ved sygdom, imidlertid, signalerne bryder op og resulterer i forvirrede beskeder og utilsigtede konsekvenser. For at hjælpe med at analysere disse signaler og hvordan de fungerer i sundhed - og gå galt i sygdom - mærker videnskabsmænd proteiner med etiketter, de kan følge, når proteinerne interagerer med den molekylære verden omkring dem.
Udfordringen er at finde ud af, hvilke proteiner der skal mærkes i første omgang. Nu, et hold ledet af forskere fra Tokyo University of Agriculture and Technology (TUAT) har udviklet en ny tilgang til at identificere og mærke de specifikke proteiner. De offentliggjorde deres resultater den 1. juni i Angewandte Chemie .
"Vi er interesserede i at udforske proteinreceptorer af visse kulhydratmolekyler, der er involveret i at mediere cellesignalering, især i kræftceller, " sagde papirforfatter Kaori Sakurai, lektor ved Institut for Bioteknologi og Biovidenskab på TUAT.
Kulhydratmolekylerne, kaldet ligander, udtrykkes typisk på overfladen af celler og er kendt for dynamisk at danne komplekser med proteinreceptorer for at koordinere komplicerede cellulære funktioner. Imidlertid, Sakurai sagde, proteinerne, der er ansvarlige for at binde kulhydraterne, har været svære at identificere, fordi de binder så svagt til molekylerne.
Forskerne designede en ny type kulhydratsonde, der ikke kun ville linke til molekylerne, men bind fast til dem.
"Vi brugte guldnanopartikler som et stillads til at vedhæfte både kulhydratligander og elektrofiler - et kemikalie, der elsker at reagere med andre molekyler - på en multivalent måde, " sagde Sakurai. "På denne måde, vi var i stand til i høj grad at øge bindingsaffiniteten og reaktionseffektiviteten over for kulhydratbindende proteiner."
Forskerne anvendte de designede prober til cellelysat, en væske, der indeholder det indre af brudte celler.
"Sonderne fandt hurtigt de kulhydratbindende målproteiner, trigger de elektrofile grupper til at reagere med elektrondonerende aminosyrerester på nærliggende proteiner, " sagde Sakurai. "Dette resulterede i proteiner, der var fast tværbundet til guld-nanopartiklernes overflade, gør det nemt efterfølgende at analysere deres identiteter."
Holdet evaluerede flere elektrofile grupper for at identificere den mest effektive type til at mærke deres målproteiner.
"Vi fandt ud af, at en bestemt elektrofil gruppe kaldet arylsulfonylfluorid er bedst egnet til affinitetsmærkning af kulhydratbindende proteiner, " sagde medforfatter Nanako Suto, en kandidatstuderende ved Institut for Bioteknologi og Biovidenskab på TUAT. "Imidlertid, de er sjældent blevet brugt til at identificere målproteiner, formentlig fordi de ikke-selektivt ville reagere med forskellige andre, uønskede proteiner."
Imidlertid, omfanget af brugen af arylsulfonylfluorid ser ud til at afbøde problemet.
"Ikke-selektiviteten er ikke et problem, hvis arylsulfonylfluorid bruges i meget lave koncentrationer, i området for nanoskalaen, " sagde medforfatter Shione Kamoshita, også en kandidatstuderende ved Institut for Bioteknologi og Biovidenskab, TUAT.
Guldnanopartikelstilladset viser mange kopier af den elektrofile gruppe, som holder arylsulfonylfluorids lokale koncentration højt på nanopartikeloverfladen, men afholder dem fra det generelle cellesystem og reagerer på uønskede proteiner. Med den høje koncentration på nano-niveau, nogle kopier af elektrofile grupper kan effektivt reagere med målproteiner.
"Gennem denne proces, vi var i stand til at opnå højeffektiv og selektiv affinitetsmærkning af kulhydratbindende proteiner i cellelysat, " Sagurai sagde. "Vi vil anvende den nye metode til målidentifikation af flere kræftrelaterede kulhydratligander og undersøge deres funktion i kræftudvikling. Parallelt, vi sigter mod at udforske den generelle anvendelighed af dette nye probedesign til forskellige andre bioaktive små molekyler, så vi kan fremskynde belysningen af deres mekanismer."
 Varme artikler
Varme artikler
-
 Direkte observation af atombevægelser i elektronisk mikroskopi i realtidSkematisk illustration af atomorden i et oxid via dannelsen af punktdefekter som en forbigående tilstand. Kredit:KAIST Atomisk bevægelse i et krystallinsk oxid, der blev brugt som katode i Li-io
Direkte observation af atombevægelser i elektronisk mikroskopi i realtidSkematisk illustration af atomorden i et oxid via dannelsen af punktdefekter som en forbigående tilstand. Kredit:KAIST Atomisk bevægelse i et krystallinsk oxid, der blev brugt som katode i Li-io -
 Brug af grafen til at detektere ALS, andre neurodegenerative sygdommeHvordan grafen kan bruges til at påvise ALS-biomarkører fra cerebrospinalvæske. Kredit:Berry Research Laboratory, UIC Grafens vidundere er mange - det kan muliggøre fleksible elektroniske komponen
Brug af grafen til at detektere ALS, andre neurodegenerative sygdommeHvordan grafen kan bruges til at påvise ALS-biomarkører fra cerebrospinalvæske. Kredit:Berry Research Laboratory, UIC Grafens vidundere er mange - det kan muliggøre fleksible elektroniske komponen -
 Ny teknik kan gøre skærme lysere og få smartphone -batterier til at holde længereMikroskopbilleder af chirale lag af kulstofbaserede polymerer til lysemitterende dioder. Kredit:Imperial College London Vores fremtidige tv- og smartphone-skærme kan have dobbelt så meget energief
Ny teknik kan gøre skærme lysere og få smartphone -batterier til at holde længereMikroskopbilleder af chirale lag af kulstofbaserede polymerer til lysemitterende dioder. Kredit:Imperial College London Vores fremtidige tv- og smartphone-skærme kan have dobbelt så meget energief -
 Forskere demonstrerer teoretisk påvisning af et enkelt nuklear spin ved stuetemperaturOpsætning. Kredit: Naturnanoteknologi (2015) doi:10.1038/nnano.2015.74 For første gang, en forsker ved University of Waterloo har teoretisk vist, at det er muligt at opdage et enkelt atomspin ved
Forskere demonstrerer teoretisk påvisning af et enkelt nuklear spin ved stuetemperaturOpsætning. Kredit: Naturnanoteknologi (2015) doi:10.1038/nnano.2015.74 For første gang, en forsker ved University of Waterloo har teoretisk vist, at det er muligt at opdage et enkelt atomspin ved
- Import af fødevarer skader det hjemlige miljø
- Nanotråds position og orientering styres præcist ved hjælp af væskeflow
- Fulleren kemi med silicium
- Knækker koden til soddannelse - forskere låser op for mysterium for at hjælpe med at reducere far…
- Brug af grafen og små dråber til at opdage mavekræftfremkaldende bakterier
- At kaste lys over moiré-excitons:Et første-principper-perspektiv


